એલેસિયો નેન્સિઓની, ઇરેન કાફા, સાલ્વાટોર કોર્ટીનો
અમૂર્ત | પોષક તત્ત્વોની ઉણપ માટે કેન્સરના કોષોની નબળાઈ અને ચોક્કસ ચયાપચય પરની તેમની અવલંબન એ કેન્સરના ઉભરતા લક્ષણો છે. ઉપવાસ અથવા ઉપવાસ-અનુકરણ આહાર (FMDs) વૃદ્ધિના પરિબળો અને ચયાપચયના સ્તરોમાં વ્યાપક ફેરફારો તરફ દોરી જાય છે, એવા વાતાવરણનું નિર્માણ કરે છે જે કેન્સરના કોષોની અનુકૂલન અને ટકી રહેવાની ક્ષમતાને ઘટાડી શકે છે અને આમ કેન્સર ઉપચારની અસરોમાં સુધારો કરે છે. વધુમાં, ઉપવાસ અથવા એફએમડી સામાન્ય રીતે કેમોથેરાપી સામે પ્રતિકાર વધારે છે પરંતુ કેન્સરના કોષોમાં નહીં અને સામાન્ય પેશીઓમાં પુનર્જીવનને પ્રોત્સાહન આપે છે, જે સારવારની હાનિકારક અને સંભવિત જીવલેણ આડઅસરને રોકવામાં મદદ કરી શકે છે. જ્યારે દર્દીઓ દ્વારા ઉપવાસ ભાગ્યે જ સહન કરવામાં આવે છે, બંને પ્રાણીઓ અને તબીબી અભ્યાસો દર્શાવે છે કે ઓછી કેલરી એફએમડીના ચક્ર શક્ય અને એકંદરે સલામત છે. ઉપવાસ અથવા એફએમડીની અસરનું મૂલ્યાંકન કરતી કેટલીક ક્લિનિકલ ટ્રાયલ્સ સારવાર-ઉભરતી પ્રતિકૂળ ઘટનાઓ અને અસરકારકતાના પરિણામો પર ચાલુ છે. અમે દરખાસ્ત કરીએ છીએ કે કીમોથેરાપી, ઇમ્યુનોથેરાપી અથવા અન્ય સારવારો સાથે FMDsનું સંયોજન સારવારની અસરકારકતા વધારવા, પ્રતિકાર સંપાદન અટકાવવા અને આડઅસરો ઘટાડવા માટે સંભવિત આશાસ્પદ વ્યૂહરચના રજૂ કરે છે.
આહાર અને જીવનશૈલી-સંબંધિત પરિબળો કેન્સર થવાના જોખમના મુખ્ય નિર્ણાયક છે, અમુક કેન્સર અન્ય કરતા આહારની આદતો પર વધુ આધાર રાખે છે
ભલે પાછલા દાયકામાં આપણે કેન્સરની સારવારમાં અભૂતપૂર્વ ફેરફારો અને નોંધપાત્ર પ્રગતિ જોઈ હોય 14,15, હજુ પણ વધુ અસરકારક અને સંભવતઃ,
ઉપવાસ તંદુરસ્ત કોષોને ધીમા વિભાજન અને અત્યંત સંરક્ષિત મોડમાં પ્રવેશવા દબાણ કરે છે જે તેમને કેન્સર વિરોધી દવાઓમાંથી મેળવેલા ઝેરી અપમાન સામે રક્ષણ આપે છે જ્યારે વિવિધ પ્રકારના કેન્સર કોષોને આ થેરાપ્યુટિક્સ પ્રત્યે સંવેદનશીલ બનાવે છે11,12,17. આ શોધ સૂચવે છે કે એક જ આહાર હસ્તક્ષેપ સંભવિત રીતે કેન્સર ઉપચારના વિવિધ અને સમાન મહત્વના પાસાઓને સંબોધવામાં મદદ કરી શકે છે.
આ અભિપ્રાય લેખમાં, અમે ઉપવાસ અથવા ઉપવાસ-અનુકરણ આહાર (FMDs) નો ઉપયોગ કરીને TEAEs ને નિખારવા માટે પણ કેન્સરને રોકવા અને સારવાર માટે પણ જૈવિક તર્કની ચર્ચા કરીએ છીએ. અમે આ પ્રાયોગિક અભિગમની ચેતવણીઓ 18,19 અને પ્રકાશિત અને ચાલુ ક્લિનિકલ અભ્યાસોને પણ સમજાવીએ છીએ જેમાં કેન્સરના દર્દીઓ માટે ઉપવાસ અથવા FMDs લાગુ કરવામાં આવ્યા છે.
અનુક્રમણિકા
પ્રણાલીગત અને સેલ્યુલર ફાસ્ટિંગ રિસ્પોન્સ
ઉપવાસ મુખ્યત્વે એડિપોઝ પેશીઓમાંથી અને અમુક અંશે સ્નાયુમાંથી મુક્ત થતા કાર્બન સ્ત્રોતોનો ઉપયોગ કરીને ઊર્જા અને ચયાપચય પેદા કરવા સક્ષમ મોડમાં સ્વિચ સાથે સંકળાયેલા ઘણા મેટાબોલિક માર્ગોની પ્રવૃત્તિમાં ફેરફાર તરફ દોરી જાય છે. પરિભ્રમણ કરતા હોર્મોન્સ અને ચયાપચયના સ્તરોમાં થતા ફેરફારો કોષ વિભાજનમાં ઘટાડો કરે છે અને ચયાપચયની પ્રવૃત્તિ સામાન્ય કોષો અને આખરે તેમને કીમોથેરાપ્યુટિક અપમાનથી રક્ષણ આપે છે11,12. કેન્સરના કોષો, આ ભૂખમરાની પરિસ્થિતિઓ દ્વારા નિર્ધારિત વૃદ્ધિ-રોધી આદેશોનું ઉલ્લંઘન કરીને, સામાન્ય કોષોની વિરુદ્ધ પ્રતિક્રિયા આપી શકે છે અને તેથી તેઓ કીમોથેરાપી અને અન્ય કેન્સર ઉપચારો પ્રત્યે સંવેદનશીલ બને છે.
ઉપવાસ માટે પ્રણાલીગત પ્રતિભાવ
ઉપવાસની પ્રતિક્રિયા ગ્લુકોઝ, ઇન્સ્યુલિન, ગ્લુકોગન, ગ્રોથ હોર્મોન (GH), IGF1, ગ્લુકોકોર્ટિકોઇડ્સના પરિભ્રમણ સ્તરો દ્વારા આંશિક રીતે ગોઠવવામાં આવે છે.
ગ્લુકોગન અને ઇન્સ્યુલિનનું નીચું સ્તર પણ ટ્રાઇગ્લાઇસેરાઇડ્સ (જે મોટે ભાગે એડિપોઝ પેશીઓમાં સંગ્રહિત હોય છે) ગ્લિસરોલ અને ફ્રી ફેટી એસિડ્સમાં ભંગાણને ઉત્તેજિત કરે છે. ઉપવાસ દરમિયાન, મોટાભાગની પેશીઓ ઊર્જા માટે ફેટી એસિડનો ઉપયોગ કરે છે, જ્યારે મગજ ગ્લુકોઝ અને હેપેટોસાયટ્સ દ્વારા ઉત્પાદિત કેટોન બોડી પર આધાર રાખે છે (કેટોન બોડી ફેટી એસિડમાંથી પેદા થતા એસિટિલ-કોએમાંથી ઉત્પન્ન થઈ શકે છે?-ઓક્સિડેશન અથવા કેટોજેનિક એમિનો એસિડમાંથી). ઉપવાસના કેટોજેનિક તબક્કામાં, કેટોન બોડી મિલિમોલર શ્રેણીમાં સાંદ્રતા સુધી પહોંચે છે, સામાન્ય રીતે ઉપવાસની શરૂઆતથી 2�3 દિવસ પછી શરૂ થાય છે. ચરબીથી મેળવેલા ગ્લિસરોલ અને એમિનો એસિડ્સ સાથે મળીને, કેટોન બોડી ગ્લુકોનિયોજેનેસિસને બળતણ આપે છે, જે લગભગ 4mM (70mg per dl) ની સાંદ્રતામાં ગ્લુકોઝનું સ્તર જાળવી રાખે છે, જેનો મોટાભાગે મગજ દ્વારા ઉપયોગ થાય છે.
ગ્લુકોકોર્ટિકોઇડ્સ અને એડ્રેનાલિન પણ મેટાબોલિક અનુકૂલનને દિશામાન કરવામાં ફાળો આપે છે.
છેવટે, ઉપવાસ લેપ્ટિનના પરિભ્રમણના સ્તરને ઘટાડે છે, જે મુખ્યત્વે એડિપોસાઇટ્સ દ્વારા બનાવેલ હોર્મોન છે જે ભૂખને અટકાવે છે, જ્યારે એડિપોનેક્ટીનનું સ્તર વધે છે, જે ફેટી એસિડના ભંગાણને 23,24 વધારે છે. આમ, નિષ્કર્ષમાં, ઉપવાસ માટે સસ્તન પ્રાણીઓના પ્રણાલીગત પ્રતિભાવના લક્ષણોમાં ગ્લુકોઝ અને ઇન્સ્યુલિનનું નીચું સ્તર, ગ્લુકોગન અને કીટોન બોડીનું ઊંચું સ્તર, IGF1 અને લેપ્ટિનનું નીચું સ્તર અને એડિપોનેક્ટીનનું ઊંચું સ્તર છે.
ઉપવાસ માટે સેલ્યુલર પ્રતિસાદ
ઉપવાસ માટે તંદુરસ્ત કોશિકાઓનો પ્રતિભાવ ઉત્ક્રાંતિ રૂપે સાચવવામાં આવે છે અને કોષ સુરક્ષા પ્રદાન કરે છે, અને ઓછામાં ઓછા મોડેલ સજીવોમાં, આયુષ્ય અને આરોગ્ય 12,22,25�31 વધારવા માટે દર્શાવવામાં આવ્યું છે. IGF1
ઉપવાસ અને પરિણામી ગ્લુકોઝ પ્રતિબંધ PKA પ્રવૃત્તિને અટકાવે છે, AMPK પ્રવૃત્તિમાં વધારો કરે છે અને EGR1 ને સક્રિય કરે છે અને આ રીતે મ્યોકાર્ડિયમ 22,25,26 સહિત કોષ-રક્ષણાત્મક અસરો પ્રાપ્ત કરે છે. છેલ્લે, ઉપવાસ અને એફએમડી (તેમની રચના માટે નીચે જુઓ) પણ મોલેક્યુલર મિકેનિઝમ્સ દ્વારા પુનર્જીવિત અસરો (બોક્સ 1) ને પ્રોત્સાહન આપવાની ક્ષમતા ધરાવે છે, જેમાંથી કેટલાક કેન્સરમાં ફસાયેલા છે, જેમ કે ઓટોફેજી અથવા સિર્ટુઇન પ્રવૃત્તિમાં વધારો 22,37�49 .

કેન્સર FMDs માં આહાર અભિગમ
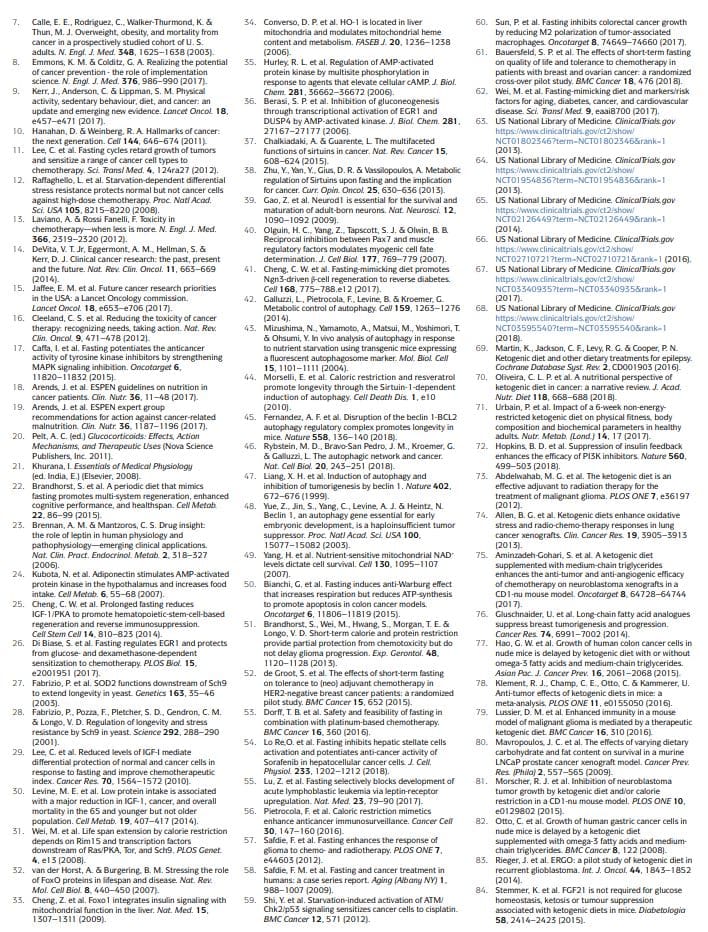
ઉપવાસ પર આધારિત આહાર અભિગમ કે જેની તપાસ ઓન્કોલોજીમાં વધુ વ્યાપક રીતે કરવામાં આવી છે, પૂર્વ-તબીબી અને તબીબી બંને રીતે, તેમાં પાણીના ઉપવાસ (પાણી સિવાયના તમામ ખોરાક અને પીણાંનો ત્યાગ) અને FMDs11,12,17,25,26,50�60 (કોષ્ટક) નો સમાવેશ થાય છે. 1). પ્રારંભિક ક્લિનિકલ ડેટા સૂચવે છે કે ઓન્કોલોજીમાં તબીબી રીતે અર્થપૂર્ણ અસરો પ્રાપ્ત કરવા માટે ઓછામાં ઓછા 48 કલાકના ઉપવાસની જરૂર પડી શકે છે, જેમ કે કીમોથેરાપી-પ્રેરિત ડીએનએને તંદુરસ્ત પેશીઓને થતા નુકસાનને અટકાવવા અને જાળવવામાં મદદ કરવી.
જો કે, મોટાભાગના દર્દીઓ પાણી ઉપવાસ પૂર્ણ કરવાનો ઇનકાર કરે છે અથવા મુશ્કેલીઓ અનુભવે છે, અને તેની સાથે સંકળાયેલ વિસ્તૃત કેલરી અને સૂક્ષ્મ પોષકતત્વોની ઉણપના સંભવિત જોખમોને ન્યાયી ઠેરવવો મુશ્કેલ છે. FMDs એ તબીબી રીતે રચાયેલ આહાર વ્યવસ્થા છે જેમાં ખૂબ જ ઓછી કેલરી હોય છે (એટલે કે, સામાન્ય રીતે 300 થી 1,100kcal પ્રતિ દિવસની વચ્ચે), ખાંડ અને પ્રોટીન કે જે માત્ર પાણી-માત્ર ઉપવાસની ઘણી અસરોને ફરીથી બનાવે છે પરંતુ દર્દીના વધુ સારા અનુપાલન અને ઘટાડેલા પોષણ જોખમ સાથે22,61,62, 3. એફએમડી દરમિયાન, દર્દીઓને સામાન્ય રીતે અપ્રતિબંધિત માત્રામાં પાણી, વનસ્પતિ સૂપ, સૂપ, જ્યુસ, નટ બાર અને હર્બલ ટીના નાના, પ્રમાણિત ભાગો તેમજ સૂક્ષ્મ પોષકતત્વોના પૂરક મળે છે. સામાન્ય રીતે સ્વસ્થ વિષયોમાં 5-દિવસના FMD ના 1 માસિક ચક્રના ક્લિનિકલ અભ્યાસમાં, આહાર સારી રીતે સહન કરવામાં આવ્યો હતો અને થડ અને કુલ શરીરની ચરબી, બ્લડ પ્રેશર અને IGF62 સ્તરમાં ઘટાડો થયો હતો. અગાઉના અને ચાલુ ઓન્કોલોજિકલ ક્લિનિકલ ટ્રાયલ્સમાં, ઉપવાસ અથવા એફએમડી સામાન્ય રીતે દર 3�4 અઠવાડિયે આપવામાં આવે છે, ઉદાહરણ તરીકે, કીમોથેરાપીના સંયોજનમાં, અને તેમની અવધિ 1 થી 5 દિવસની વચ્ચે હોય છે52,53,58,61,63�68 . અગત્યની રીતે, આ અભ્યાસમાં કોઈ ગંભીર પ્રતિકૂળ ઘટનાઓ (લેવલ G3 અથવા તેથી ઉપર, પ્રતિકૂળ ઘટનાઓ માટે સામાન્ય પરિભાષા માપદંડો અનુસાર) નોંધવામાં આવી ન હતી52,53,58,61.
કેટોજેનિક આહાર
કેટોજેનિક આહાર (KDs) એ આહારની પદ્ધતિ છે જેમાં સામાન્ય કેલરી, ઉચ્ચ ચરબી અને ઓછી કાર્બોહાઇડ્રેટ સામગ્રી 69,70 હોય છે. ક્લાસિકલ કેડીમાં, ચરબીના વજન અને કાર્બોહાઇડ્રેટ અને પ્રોટીનના સંયુક્ત વજન વચ્ચેનો ગુણોત્તર 4:1 છે. નોંધનીય છે કે, એફએમડી પણ કેટોજેનિક છે કારણ કે તેમાં ચરબીનું પ્રમાણ વધુ હોય છે અને પરિભ્રમણ કરતા કીટોન બોડીના સ્તરોમાં નોંધપાત્ર ઉન્નતિ (? 0.5 એમએમઓએલ પ્રતિ લીટર) લાવવાની ક્ષમતા હોય છે. મનુષ્યોમાં, KD IGF1 અને ઇન્સ્યુલિનના સ્તરને પણ ઘટાડી શકે છે (બેઝલાઇન મૂલ્યોથી 20% થી વધુ), જો કે આ અસરો ખોરાકમાં કાર્બોહાઇડ્રેટ્સ અને પ્રોટીનના સ્તરો અને પ્રકારોથી પ્રભાવિત થાય છે71. KDs લોહીમાં શર્કરાનું સ્તર ઘટાડી શકે છે, પરંતુ તે સામાન્ય રીતે સામાન્ય શ્રેણીમાં રહે છે (એટલે કે>4.4mmol પ્રતિ લીટર)71.
નોંધનીય રીતે, KDs ગ્લુકોઝ અને ઇન્સ્યુલિનના વધારાને રોકવા માટે અસરકારક હોઈ શકે છે જે સામાન્ય રીતે PI3K અવરોધકોના પ્રતિભાવમાં થાય છે, જે તેમની અસરકારકતાને મર્યાદિત કરવા માટે પ્રસ્તાવિત કરવામાં આવી હતી. પરંપરાગત રીતે, KDs નો ઉપયોગ પ્રત્યાવર્તન વાઈની સારવાર માટે કરવામાં આવે છે, મુખ્યત્વે બાળકોમાં72. માઉસ મોડેલોમાં, KDs કેન્સર વિરોધી અસરોને પ્રેરિત કરે છે, ખાસ કરીને ગ્લિઓબ્લાસ્ટોમા69�70,72માં. ક્લિનિકલ અભ્યાસો સૂચવે છે કે કેન્સરના દર્દીઓમાં સિંગલ એજન્ટ તરીકે ઉપયોગ કરવામાં આવે ત્યારે KDsમાં કદાચ કોઈ નોંધપાત્ર રોગનિવારક પ્રવૃત્તિ હોતી નથી અને સૂચવે છે કે આ આહારના સંભવિત લાભો અન્ય અભિગમો, જેમ કે કીમોથેરાપી, રેડિયોથેરાપી, એન્ટિએન્જિયોજેનિક સારવાર, PI86K અવરોધકો સાથે સંયોજનમાં મેળવવા જોઈએ.
પેરિફેરલ ચેતા અને હિપ્પોકેમ્પસ 87,88 માં KDs ને ન્યુરોપ્રોટેક્ટીવ અસરો હોવાનું નોંધવામાં આવ્યું હતું. જો કે, તે સ્થાપિત કરવાનું બાકી છે કે શું KDs માં પણ ઉપવાસ અથવા FMDs (બોક્સ 1) જેવી જ પ્રજનન અસરો હોય છે અને શું KDsનો ઉપયોગ જીવંત સસ્તન પ્રાણીઓને કીમોથેરાપીની ઝેરી અસરથી બચાવવા માટે પણ થઈ શકે છે. નોંધનીય રીતે, ઉપવાસ અથવા એફએમડીની પુનર્જીવિત અસરો ભૂખમરો-પ્રતિભાવ મોડમાંથી સ્વિચ દ્વારા મહત્તમ કરવામાં આવે છે, જેમાં સેલ્યુલર ઘટકોના ભંગાણ અને ઘણા કોષોના મૃત્યુ અને પુનઃ ખોરાકનો સમયગાળો સામેલ છે, જેમાં કોષો અને પેશીઓ પસાર થાય છે. પુનર્નિર્માણ22. કારણ કે KDs ભૂખમરાના મોડમાં પ્રવેશ માટે દબાણ કરતા નથી, અંતઃકોશિક ઘટકો અને પેશીઓના મોટા ભંગાણને પ્રોત્સાહન આપતા નથી અને રિફીડિંગ પીરિયડનો સમાવેશ કરતા નથી, તેઓ FMD રિફીડિંગ દરમિયાન જોવા મળતા સંકલિત પુનર્જીવનના પ્રકારનું કારણ બને તેવી શક્યતા નથી.
કેલરી પ્રતિબંધ
જ્યારે ક્રોનિક કેલરી પ્રતિબંધ (CR) અને ચોક્કસ એમિનો એસિડની ઉણપ ધરાવતો આહાર સામયિક ઉપવાસ કરતા ઘણો અલગ છે, તેઓ ઉપવાસ અને FMD સાથે પોષક તત્ત્વોમાં વધુ કે ઓછા પસંદગીયુક્ત પ્રતિબંધો વહેંચે છે, અને તેમની કેન્સર વિરોધી અસરો છે81,89�112. CR માં સામાન્ય રીતે પ્રમાણભૂત કેલરીના સેવનથી ઊર્જાના વપરાશમાં 20–30% નો ક્રોનિક ઘટાડો સામેલ છે જે વ્યક્તિનું સામાન્ય વજન 113,114 જાળવી શકે છે. પ્રાઈમેટસ108,109,114 સહિત મોડેલ જીવોમાં કાર્ડિયોવેસ્ક્યુલર જોખમી પરિબળો અને કેન્સરની ઘટનાઓને ઘટાડવામાં તે ખૂબ જ અસરકારક છે.
જોકે, CR આડઅસરનું કારણ બની શકે છે, જેમ કે શારીરિક દેખાવમાં ફેરફાર, ઠંડીની સંવેદનશીલતામાં વધારો, શક્તિમાં ઘટાડો, માસિક અનિયમિતતા, વંધ્યત્વ, કામવાસનામાં ઘટાડો, ઑસ્ટિયોપોરોસિસ, ધીમો ઘા રૂઝવો, ખોરાકનું વળગણ, ચીડિયાપણું અને હતાશા. કેન્સર ધરાવતા દર્દીઓમાં, એવી નોંધપાત્ર ચિંતાઓ છે કે તે કુપોષણમાં વધારો કરી શકે છે અને તે અનિવાર્યપણે દુર્બળ બોડી માસ 18,113�116 ના અતિશય નુકશાનનું કારણ બનશે. CR ફાસ્ટિંગ બ્લડ ગ્લુકોઝનું સ્તર ઘટાડે છે, જો કે તે સામાન્ય શ્રેણીમાં રહે છે114. મનુષ્યોમાં, ક્રોનિક CR IGF1 સ્તરને અસર કરતું નથી સિવાય કે મધ્યમ પ્રોટીન પ્રતિબંધ પણ અમલમાં ન આવે 117.
અભ્યાસો દર્શાવે છે કે પેનેથ કોશિકાઓમાં mTORC1 સિગ્નલિંગ ઘટાડીને, CR તેમના સ્ટેમ સેલ કાર્યમાં વધારો કરે છે અને તે અનામત આંતરડાના સ્ટેમ કોશિકાઓને DNA નુકસાન 118,119 થી પણ સુરક્ષિત કરે છે, પરંતુ તે અજ્ઞાત છે કે અન્ય અવયવોમાં પ્રો-રિજનરેટિવ અસરો પણ CR દ્વારા પ્રાપ્ત થાય છે કે કેમ. આમ, ઉપલબ્ધ ડેટા સૂચવે છે કે ઉપવાસ અને એફએમડી એક મેટાબોલિક, પુનર્જીવિત અને રક્ષણાત્મક પ્રોફાઇલ બનાવે છે જે KD અથવા CR દ્વારા બહાર પાડવામાં આવેલ કરતાં અલગ અને કદાચ વધુ શક્તિશાળી છે.
ઉપચારમાં ઉપવાસ અને એફએમડી: હોર્મોન અને મેટાબોલાઇટ સ્તરો પર અસરો
પરિભ્રમણ કરતા હોર્મોન્સ અને ચયાપચયના સ્તરોમાંના ઘણા ફેરફારો કે જે સામાન્ય રીતે ઉપવાસના પ્રતિભાવમાં જોવા મળે છે તેમાં એન્ટિટ્યુમર અસરો (એટલે કે, ગ્લુકોઝ, IGF1, ઇન્સ્યુલિન અને લેપ્ટિનના સ્તરમાં ઘટાડો અને એડિપોનેક્ટીનનું સ્તર વધે છે) 23,120,121 અને/ અથવા આડઅસર (એટલે કે, IGF1 અને ગ્લુકોઝનું ઘટાડેલું સ્તર) થી તંદુરસ્ત પેશીઓનું રક્ષણ પરવડી શકે છે. કારણ કે કેટોન બોડી હિસ્ટોન ડીસીટીલેસીસ (HDACs) ને અટકાવી શકે છે, કેટોન બોડીઝના ઉપવાસ-પ્રેરિત વધારો ગાંઠના વિકાસને ધીમું કરવામાં મદદ કરી શકે છે અને એપિજેનેટિક મિકેનિઝમ્સ122 દ્વારા તફાવતને પ્રોત્સાહન આપી શકે છે.
જો કે, કેટોન બોડી એસીટોએસેટેટ અમુક ગાંઠોની વૃદ્ધિને બદલે, જેમ કે પરિવર્તિત BRAF123 સાથે મેલાનોમાસની વૃદ્ધિને વેગ આપે છે. કેન્સર સામે ઉપવાસ અને એફએમડીની ફાયદાકારક અસરોમાં ભૂમિકા માટે સૌથી મજબૂત પુરાવા છે તે ફેરફારો IGF1 અને ગ્લુકોઝના સ્તરોમાં ઘટાડો છે. પરમાણુ સ્તરે, ઉપવાસ અથવા એફએમડી IGF1R�AKT�mTOR�S6K અને cAMP�PKA સિગ્નલિંગ સહિત ઈન્ટ્રાસેલ્યુલર સિગ્નલિંગ કાસ્કેડને ઘટાડે છે, ઓટોફેજી વધારે છે, સામાન્ય કોષોને તાણનો સામનો કરવામાં મદદ કરે છે અને કેન્સર વિરોધી પ્રતિરક્ષાને પ્રોત્સાહન આપે છે25,29,56,124
વિભેદક તાણ પ્રતિકાર: કીમોથેરાપી સહનશીલતામાં વધારો
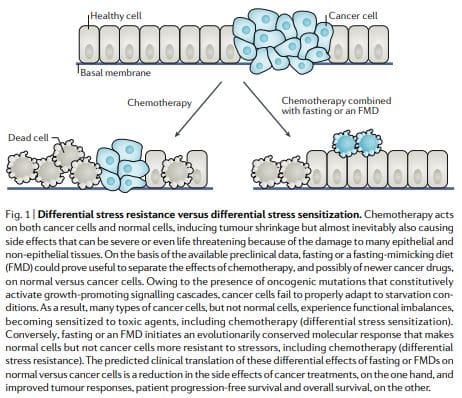
કેટલાક યીસ્ટ ઓન્કોજીન ઓર્થોલોગ્સ, જેમ કે રાસ અને શ્9 (સસ્તન પ્રાણી S6K ના કાર્યાત્મક ઓર્થોલોગ), મોડેલ સજીવો 27,28 માં તણાવ પ્રતિકાર ઘટાડવામાં સક્ષમ છે. વધુમાં, પરિવર્તન કે જે IGF1R, RAS, PI3KCA અથવા AKT ને સક્રિય કરે છે અથવા જે PTEN ને નિષ્ક્રિય કરે છે, તે મોટાભાગના માનવ કેન્સર10માં હાજર છે. એકસાથે, આનાથી એવી ધારણા થઈ કે ભૂખમરો કેન્સર વિરુદ્ધ સામાન્ય કોષોમાં કેમોથેરાપ્યુટિક્સ સહિત કોષોના તાણનો સામનો કરવાની તેમની ક્ષમતાના સંદર્ભમાં વિપરીત અસરો પેદા કરશે. બીજા શબ્દોમાં કહીએ તો, ભૂખમરો પરિણમી શકે છે
DSR પૂર્વધારણા અનુસાર, સામાન્ય કોષો પ્રસારને સંલગ્ન અને રાઈબોઝોમ બાયોજેનેસિસ અને/અથવા એસેમ્બલી જીન્સને ડાઉન રેગ્યુલેટ કરીને ભૂખમરોનો પ્રતિભાવ આપે છે, જે કોષોને સ્વ-જાળવણી મોડમાં પ્રવેશવા દબાણ કરે છે અને તેમને કીમોથેરાપી, રેડિયોથેરાપી અને અન્ય ઝેરી એજન્ટો દ્વારા થતા નુકસાનથી રક્ષણ આપે છે. તેનાથી વિપરિત, કેન્સર કોષોમાં, આ સ્વ-જાળવણી મોડને ઓન્કોજેનિક ફેરફારો દ્વારા અટકાવવામાં આવે છે, જે તણાવ પ્રતિભાવ માર્ગો12 (ફિગ. 1) ના રચનાત્મક અવરોધનું કારણ બને છે. ડીએસઆર મોડલ સાથે સુસંગત, ટૂંકા ગાળાની ભૂખમરો અથવા પ્રોટો-ઓન્કોજીન કાઢી નાખવું
સમાન પરિણામો સ્તન્ય પ્રાણીઓમાં ગર્ભમાં રહેલા બચ્ચાની રક્ષા માટેનું આચ્છાદન પ્રાપ્ત થયું હતું: ઓછા ગ્લુકોઝ મીડિયાના સંપર્કમાં પ્રાથમિક માઉસ ગ્લિયા કોષોને હાઇડ્રોજન પેરોક્સાઇડ અથવા સાયક્લોફોસ્ફેમાઇડ (એક પ્રોઓક્સિડન્ટ કીમોથેરાપ્યુટિક) ના ઝેરી અસર સામે રક્ષણ આપે છે પરંતુ ઉંદર, ઉંદર અને માનવ ગ્લિઓમા અને ન્યુરોબ્લાસ્ટોમા કેન્સર સેલ લાઇનનું રક્ષણ કરતું નથી. આ અવલોકનો સાથે સુસંગત,
અનુગામી અભ્યાસમાં જાણવા મળ્યું છે કે ઉપવાસના પ્રતિભાવમાં IGF1 સિગ્નલિંગમાં ઘટાડો પ્રાથમિક ગ્લિયા અને ચેતાકોષોને સુરક્ષિત કરે છે, પરંતુ ગ્લિઓમા અને ન્યુરોબ્લાસ્ટોમા કોષોને સાયક્લોફોસ્ફેમાઇડ અને પ્રો-ઓક્સિડેટીવ સંયોજનોથી સુરક્ષિત કરે છે અને ડોક્સોરુબિસીન29 થી માઉસ એમ્બ્રોનિક ફાઇબ્રોબ્લાસ્ટ્સનું રક્ષણ કરે છે. લિવર IGF1-ઉણપ (LID) ઉંદર, શરતી યકૃત Igf1 જનીન કાઢી નાખવા સાથે ટ્રાન્સજેનિક પ્રાણીઓ કે જે પરિભ્રમણ કરતા IGF70 સ્તરોમાં 80�1% ઘટાડો દર્શાવે છે (ઉંદરમાં 72-કલાકના ઝડપી દ્વારા હાંસલ કરેલા સ્તરો જેવા જ સ્તર) 29,125 સામે રક્ષણ આપવામાં આવ્યું હતું. ચારમાંથી ત્રણ કીમોથેરાપી દવાઓનું પરીક્ષણ કરવામાં આવ્યું, જેમાં ડોક્સોરુબિસિનનો સમાવેશ થાય છે.
હિસ્ટોલોજીના અભ્યાસોએ ડોક્સોરુબિસિન-પ્રેરિત કાર્ડિયાક માયોપથીના સંકેતો માત્ર ડોક્સોરુબિસિન-સારવાર કરાયેલ નિયંત્રણ ઉંદરમાં દર્શાવ્યા હતા પરંતુ LID ઉંદરમાં નહીં. ડોક્સોરુબિસિન સાથે સારવાર કરાયેલ મેલાનોમા ધરાવતા પ્રાણીઓ સાથેના પ્રયોગોમાં, નિયંત્રણ અને LID ઉંદર વચ્ચે રોગના વિકાસના સંદર્ભમાં કોઈ તફાવત જોવા મળ્યો ન હતો, જે દર્શાવે છે કે IGF1 સ્તર ઘટાડીને કેન્સરના કોષો કીમોથેરાપીથી સુરક્ષિત નથી. તેમ છતાં, ફરીથી, ગાંઠ ધરાવતા LID ઉંદરોએ ડોક્સોરુબિસિન ઝેરીતા 29 સામે ટકી રહેવાની તેમની ક્ષમતાને કારણે નિયંત્રણ પ્રાણીઓની તુલનામાં નોંધપાત્ર અસ્તિત્વ લાભ દર્શાવ્યો હતો. આમ, એકંદરે, આ પરિણામોએ પુષ્ટિ કરી છે કે IGF1 ડાઉનરેગ્યુલેશન એ એક મુખ્ય પદ્ધતિ છે જેના દ્વારા ઉપવાસ કરવાથી કીમોથેરાપી સહનશીલતા વધે છે.
ડેક્સામેથાસોન અને એમટીઓઆર ઇન્હિબિટર્સ બંનેનો વ્યાપકપણે કેન્સરની સારવારમાં ઉપયોગ થાય છે, કાં તો તેમની એન્ટિ-ઇમેટિક્સ તરીકેની અસરકારકતાને કારણે અને
આ દરમિયાનગીરીઓ PKA પ્રવૃત્તિ ઘટાડે છે જ્યારે AMPK પ્રવૃત્તિમાં વધારો કરે છે અને ત્યાં EGR1 ને સક્રિય કરે છે, જે દર્શાવે છે કે cAMP PKA સિગ્નલિંગ EGR1 (રેફ. 26) દ્વારા ઉપવાસ-પ્રેરિત DSR ની મધ્યસ્થી કરે છે. EGR1 કાર્ડિયોપ્રોટેક્ટીવ પેપ્ટાઈડ્સની અભિવ્યક્તિને પણ પ્રોત્સાહન આપે છે, જેમ કે એટ્રીયલ નેટ્રીયુરેટીક પેપ્ટાઈડ (ANP) અને હૃદયની પેશીઓમાં B-ટાઈપ નેટ્રીયુરેટીક પેપ્ટાઈડ (BNP), જે ડોક્સોરુબીસીન સામે પ્રતિકારમાં ફાળો આપે છે. વધુમાં, ઉપવાસ અને/અથવા એફએમડી ઓટોફેજીને વધારીને ડોક્સોરુબીસિન-પ્રેરિત કાર્ડિયોમાયોપથીથી ઉંદરને સુરક્ષિત કરી શકે છે, જે નિષ્ક્રિય મિટોકોન્ડ્રિયાને નાબૂદ કરીને અને ઝેરી એકત્રીકરણને દૂર કરીને પ્રતિક્રિયાશીલ ઓક્સિજન પ્રજાતિઓ (આરઓએસ) ઉત્પાદનને ઘટાડીને સેલ્યુલર આરોગ્યને પ્રોત્સાહન આપી શકે છે.
કોશિકાઓમાં કીમોથેરાપી પ્રેરિત ઝેરી અસર ઘટાડવા અને કીમોથેરાપી-સારવાર કરાયેલ ઉંદરોના અસ્તિત્વમાં વધારો કરવા ઉપરાંત, ઉપવાસના ચક્ર અસ્થિમજ્જાના પુનર્જીવનને પ્રેરિત કરે છે અને PKA-સંબંધિત અને IGF1-સંબંધિત રીતે 25 માં સાયક્લોફોસ્ફામાઇડ દ્વારા થતા રોગપ્રતિકારક શક્તિને અટકાવે છે. આમ, અનિવાર્ય પ્રીક્લિનિકલ પરિણામો કીમોથેરાપી સહનશીલતા વધારવા અને મોટી આડ અસરોને ટાળવા માટે ઉપવાસ અને એફએમડીની સંભવિતતા દર્શાવે છે. કારણ કે પ્રારંભિક ક્લિનિકલ ડેટા આ સંભવિતને વધુ સમર્થન આપે છે, આ પૂર્વ-ક્લિનિકલ અભ્યાસો પ્રાથમિક અંતિમ બિંદુ તરીકે TEAEs સાથે રેન્ડમાઇઝ્ડ ક્લિનિકલ ટ્રાયલ્સમાં FMDsનું મૂલ્યાંકન કરવા માટે મજબૂત તર્કનું નિર્માણ કરે છે.
ડિફરન્શિયલ સ્ટ્રેસ સેન્સિટાઇઝેશન: કેન્સર કોષોના મૃત્યુમાં વધારો
જો એકલાનો ઉપયોગ કરવામાં આવે તો, ઉપવાસ અને FMDs સહિત મોટા ભાગના આહારના હસ્તક્ષેપોની કેન્સરની પ્રગતિ સામે મર્યાદિત અસરો હોય છે. ડિફરન્શિયલ સ્ટ્રેસ સેન્સિટાઇઝેશન (ડીએસએસ) પૂર્વધારણા અનુસાર, બીજી સારવાર સાથે ઉપવાસ અથવા એફએમડીનું સંયોજન વધુ આશાસ્પદ છે 11,12. આ પૂર્વધારણા એવી આગાહી કરે છે કે, જ્યારે કેન્સરના કોષો મર્યાદિત ઓક્સિજન અને પોષક તત્ત્વોની સાંદ્રતા સાથે અનુકૂલન કરવામાં સક્ષમ હોય છે, ત્યારે ઘણા પ્રકારના કેન્સરના કોષો એવા ફેરફારોને અમલમાં મૂકી શકતા નથી કે જે ઉપવાસ અને કીમોથેરાપીના સંયોજનથી પેદા થતા પોષક તત્વોની ઉણપ અને ઝેરી વાતાવરણમાં અસ્તિત્વ ટકાવી શકે. , દાખ્લા તરીકે. સ્તન કેન્સર, મેલાનોમામાં પ્રારંભિક પ્રયોગો
અમે IGF1 માં ઘટાડો અને ઉપવાસ અથવા FMDs ને કારણે થતા ગ્લુકોઝ સ્તરો સહિત બદલાયેલી પરિસ્થિતિઓમાં કેન્સરના કોષોના આવા અયોગ્ય પ્રતિભાવને મુખ્ય પદ્ધતિ તરીકે ધ્યાનમાં લઈએ છીએ.

ગ્લુકોઝની પ્રાપ્યતા ઘટાડીને અને ફેટી એસિડ વધારીને?-ઓક્સિડેશન, ઉપવાસ અથવા FMDs એરોબિક ગ્લાયકોલિસિસ (વોરબર્ગ ઇફેક્ટ) થી કેન્સર કોશિકાઓમાં માઇટોકોન્ડ્રીયલ ઓક્સિડેટીવ ફોસ્ફોરાયલેશન તરફ ફેરબદલને પ્રોત્સાહન આપી શકે છે, જે અત્યંત પોષક-નબળા વાતાવરણમાં કેન્સરના કોષોની વૃદ્ધિને ટકાવી રાખવા માટે જરૂરી છે. (ફિગ. 50). આ સ્વિચ માઇટોકોન્ડ્રીયલ શ્વસન પ્રવૃત્તિમાં વધારો થવાના પરિણામે ROS ઉત્પાદન2માં વધારો તરફ દોરી જાય છે અને ગ્લાયકોલિસિસ અને પેન્ટોઝ ફોસ્ફેટ પાથવે 11 થી ગ્લુટાથિઓન સંશ્લેષણમાં ઘટાડો થવાને કારણે સેલ્યુલર રેડોક્સ સંભવિતમાં ઘટાડો પણ સામેલ હોઈ શકે છે. ROS વૃદ્ધિની સંયુક્ત અસર અને એન્ટીઑકિસડન્ટ સંરક્ષણમાં ઘટાડો કેન્સરના કોષોમાં ઓક્સિડેટીવ તણાવને વેગ આપે છે અને કીમોથેરાપ્યુટિક્સની પ્રવૃત્તિને વિસ્તૃત કરે છે. નોંધનીય રીતે, કારણ કે ઉચ્ચ-લેક્ટેટ ઉત્પાદન દ્વારા દર્શાવવામાં આવેલી ઉચ્ચ ગ્લાયકોલિટીક પ્રવૃત્તિ વિવિધ પ્રકારના કેન્સરમાં આક્રમકતા અને મેટાસ્ટેટિક વલણની આગાહી કરે છે50, ઉપવાસ અથવા FMD ની એન્ટિ-વોરબર્ગ અસરો આક્રમક અને મેટાસ્ટેટિક કેન્સર સામે ખાસ કરીને અસરકારક બનવાની ક્ષમતા ધરાવે છે.
ચયાપચયમાં ફેરફાર ઉપરાંત, ઉપવાસ અથવા એફએમડી અન્ય ફેરફારો લાવે છે જે સ્વાદુપિંડના કેન્સર કોષોમાં ડીએસએસને પ્રોત્સાહન આપી શકે છે. ઉપવાસથી અભિવ્યક્તિનું સ્તર વધે છે
છેવટે, ઉપવાસ લેપ્ટિન રીસેપ્ટર અને તેના ડાઉનસ્ટ્રીમને અપરેગ્યુલેટ કરી શકે છે
નોંધનીય રીતે, એવી શક્યતા છે કે AML29 સહિત ઘણા કેન્સરના કોષો, ઉપવાસ અથવા FMDs દ્વારા લાદવામાં આવેલા મેટાબોલિક ફેરફારોને અટકાવીને પ્રતિકાર પ્રાપ્ત કરી શકે છે, જે મેટાબોલિક વિજાતીયતા દ્વારા વધુ વધે છે જે ઘણા કેન્સર 129 ની લાક્ષણિકતા ધરાવે છે. આમ, નજીકના ભવિષ્ય માટે એક મુખ્ય ધ્યેય બાયોમાર્કર્સ દ્વારા કેન્સરના પ્રકારોને ઓળખવાનું રહેશે કે જે આ આહારની પદ્ધતિઓ માટે સૌથી વધુ સંવેદનશીલ છે. બીજી બાજુ, જ્યારે પ્રમાણભૂત ઉપચારો સાથે જોડવામાં આવે ત્યારે, ઉપવાસ અથવા એફએમડી કેન્સરના માઉસ મોડલમાં ભાગ્યે જ પ્રતિરોધક ક્ષમતા પ્રાપ્ત કરે છે, અને કીમોથેરાપી સાથે જોડાઈને ઉપવાસનો પ્રતિકાર પણ વિટ્રોના અભ્યાસોમાં અસામાન્ય છે, જે ઉપચારની ઓળખના મહત્વને રેખાંકિત કરે છે, જ્યારે FMDs સાથે જોડવામાં આવે છે, ત્યારે સામાન્ય કોષો અને પેશીઓમાં ન્યૂનતમ ઝેરીતા સાથે કેન્સરના કોષો સામે શક્તિશાળી ઝેરી અસર થાય છે11,17,50,55�57,59,124.
ઉપવાસ અથવા એફએમડી દ્વારા એન્ટિટ્યુમર રોગપ્રતિકારક શક્તિમાં વધારો
તાજેતરના ડેટા સૂચવે છે કે ઉપવાસ અથવા એફએમડી જાતે જ, અને વધુ અંશે જ્યારે કીમોથેરાપી સાથે જોડવામાં આવે છે, ત્યારે લિમ્ફોઇડ પ્રોજેનિટર્સના વિસ્તરણને ટ્રિગર કરે છે અને પ્રોત્સાહન આપે છે.
માઉસ મોડલ્સમાં કેન્સર વિરોધી આહાર
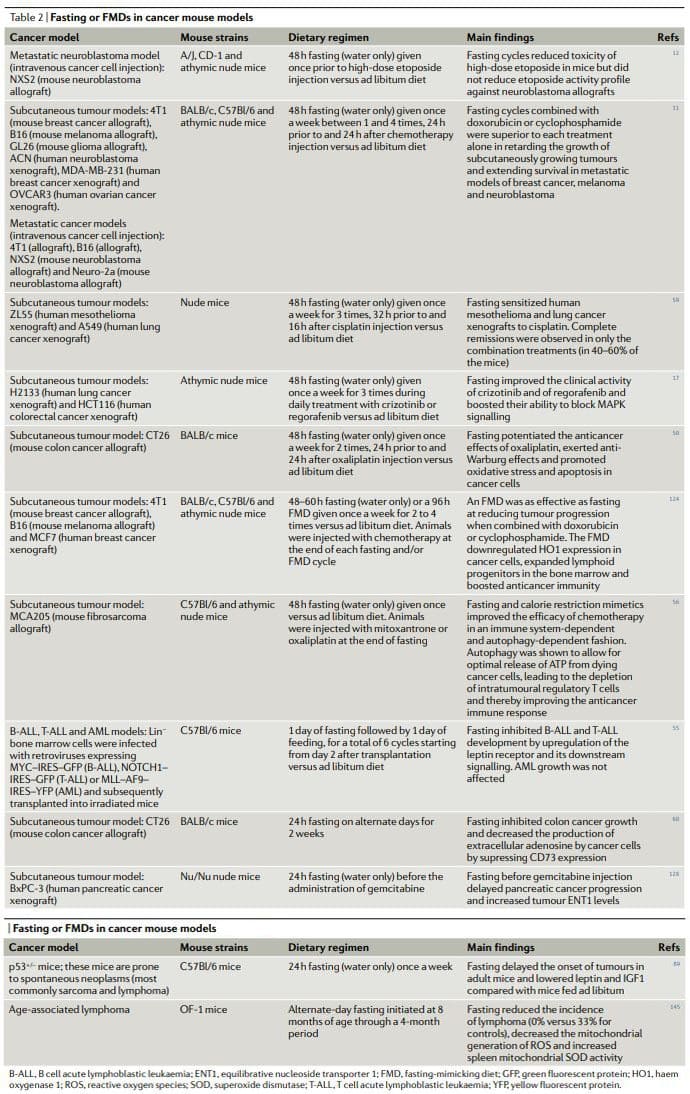
એકંદરે, મેટાસ્ટેટિક કેન્સર (કોષ્ટક 2) માટેના મોડેલો સહિત પ્રાણીઓના કેન્સર મોડેલોમાં ઉપવાસ અથવા એફએમડીના પૂર્વનિર્ધારણ અભ્યાસના પરિણામો દર્શાવે છે કે સામયિક ઉપવાસ અથવા એફએમડી પ્લીયોટ્રોપિક એન્ટિકેન્સર અસરો પ્રાપ્ત કરે છે અને રક્ષણાત્મક અને પુનર્જીવિત અસરોનો ઉપયોગ કરતી વખતે કીમોથેરાપ્યુટિક્સ અને ટીકેઆઈની પ્રવૃત્તિને સંભવિત બનાવે છે. બહુવિધ અવયવોમાં 22,25. ઉપવાસ અને/અથવા એફએમડી વિના સમાન અસરો પ્રાપ્ત કરવા માટે પહેલા ઓળખની જરૂર પડશે અને પછી બહુવિધ અસરકારક, ખર્ચાળ અને વારંવાર ઝેરી દવાઓનો ઉપયોગ કરવો પડશે અને સંભવતઃ તંદુરસ્ત કોષ સુરક્ષા પ્રેરિત કરવાના લાભ વિના હશે. નોંધનીય છે કે ઓછામાં ઓછા બે અભ્યાસોમાં કીમોથેરાપી સાથે જોડાઈને ઉપવાસ એ એકમાત્ર હસ્તક્ષેપ સાબિત થયો છે જે સારવાર કરાયેલા પ્રાણીઓના સતત અપૂર્ણાંકમાં ગાંઠના સંપૂર્ણ રીગ્રેશન અથવા લાંબા ગાળાના અસ્તિત્વને હાંસલ કરવામાં સક્ષમ છે11,59
ક્રોનિક KDs એ પણ દર્શાવે છે
CR એ આનુવંશિક માઉસ કેન્સર મોડલ, સ્વયંસ્ફુરિત ટ્યુમોરીજેનેસિસ અને કાર્સિનોજેન પ્રેરિત કેન્સર માઉસ મોડલ્સ સાથેના માઉસ મોડલ્સ, તેમજ વાંદરાઓમાં 91,92,97,98,101,102,104�106,108,109,136. તેનાથી વિપરીત, એક અભ્યાસમાં જાણવા મળ્યું છે કે મધ્યમ વયના CR ખરેખર C138Bl/57 ઉંદરોમાં પ્લાઝ્મા સેલ નિયોપ્લાઝમની ઘટનાઓને વધારે છે. જો કે, એ જ અભ્યાસમાં, CR એ પણ મહત્તમ આયુષ્ય લગભગ 6% સુધી લંબાવ્યું હતું, અને કેન્સરની ઘટનાઓમાં જોવા મળેલો વધારો CRમાંથી પસાર થતા ઉંદરની લાંબી આયુષ્યને આભારી હતો, જે ઉંમરે
મહત્વપૂર્ણ રીતે, CR એ પ્રોસ્ટેટ કેન્સર 1 સામે એન્ટિઆઈજીએફ141આર એન્ટિબોડી (ગેનિટુમબ)ની પ્રવૃત્તિ, ન્યુરોબ્લાસ્ટોમા કોશિકાઓ135 સામે સાયક્લોફોસ્ફેમાઇડ અને HRAS-G12Vટ્રાન્સફોર્મ્ડ બેબી માઉસના ઝેનોગ્રાફ્સમાં ઓટોફેજી નિષેધ સહિત અનેક કેન્સર મોડલ્સમાં કેન્સર વિરોધી સારવારની પ્રવૃત્તિમાં સુધારો કર્યો છે. જો કે, CR અથવા KD એ કેન્સર વિરોધી ઉપચાર સાથે સંયોજનમાં ઉપવાસ કરતા ઓછા અસરકારક જણાય છે. માઉસના અભ્યાસમાં જાણવા મળ્યું છે કે, એકલા ઉપવાસથી વિપરીત, એકલા CR સબક્યુટેનીયસ 100T26 સ્તન સામે સીસપ્લેટિન પ્રવૃત્તિમાં વધારો કરી શક્યા નથી અને તે, ફરીથી, ટૂંકા ગાળાના ઉપવાસથી વિપરીત, CR એ ચામડીની નીચે વધતા GL4 માઉસ ગ્લિઓમાસની વૃદ્ધિને ઘટાડી શકી નથી. ગાંઠો1. આ જ અભ્યાસમાં, ઉપવાસ પણ ડોક્સોરુબીસીન51 ની સહનશીલતા વધારવામાં CR અને KD કરતાં નોંધપાત્ર રીતે વધુ અસરકારક સાબિત થયા છે. જો કે ઉપવાસ અથવા FMD, CR અને KD સંભવતઃ ઓવરલેપિંગ પર કાર્ય કરે છે અને મોડ્યુલેટ કરે છે
refeeding ના તબક્કા પછી કરી શકે છે
કેન્સર નિવારણમાં ઉપવાસ અને એફએમડી
વાંદરાઓ 108,109,144 સહિત પ્રાણીઓમાં રોગચાળાના અભ્યાસો અને અભ્યાસો અને મનુષ્યો એ ખ્યાલને સમર્થન આપે છે કે ક્રોનિક CR અને સામયિક ઉપવાસ અને/અથવા FMD માનવોમાં કેન્સર-નિવારક અસરો કરી શકે છે. તેમ છતાં, પાલનના મુદ્દાઓ અને સંભવિત આડઅસરો115ને કારણે સામાન્ય વસ્તીમાં CR ભાગ્યે જ લાગુ કરી શકાય છે. આમ, જ્યારે કેન્સરના જોખમને ઘટાડવા માટે ખોરાકને પ્રાધાન્ય આપવા (અથવા ટાળવા)ની પુરાવા-આધારિત ભલામણો તેમજ જીવનશૈલીની ભલામણો 6,8,9,15 સ્થાપિત થઈ રહી છે, ત્યારે ધ્યેય હવે ઓળખવા અને, સંભવતઃ, સારી રીતે સહન કરેલ, સમયાંતરે પ્રમાણિત કરવાનો છે. ઓછી અથવા કોઈ આડઅસર સાથેની આહારની પદ્ધતિઓ અને ક્લિનિકલ અભ્યાસમાં તેમની કેન્સર-નિવારક અસરકારકતાનું મૂલ્યાંકન કરે છે.
અગાઉ ચર્ચા કર્યા મુજબ, એફએમડી ચક્ર IGF1 અને ગ્લુકોઝનું ડાઉન રેગ્યુલેશન અને IGFBP1 અને કેટોન બોડીના અપગ્ર્યુલેશનનું કારણ બને છે, જે ઉપવાસના કારણે થતા ફેરફારો જેવા જ છે અને ઉપવાસના પ્રતિભાવના બાયોમાર્કર્સ છે22. જ્યારે C57Bl/6 ઉંદર (જે સ્વયંભૂ વિકાસ પામે છે
વૈકલ્પિક-દિવસના ઉપવાસનો અગાઉનો અભ્યાસ, જે આધેડ ઉંદરોમાં કુલ 4 મહિના માટે કરવામાં આવ્યો હતો, તેમાં એ પણ જાણવા મળ્યું હતું કે ઉપવાસથી લિમ્ફોમાની ઘટનાઓ ઘટી છે, જે તેને 33% (ઉંદર નિયંત્રણ માટે) થી 0% (ઉપવાસમાં) પર લાવે છે. પ્રાણીઓ)145, જો કે અભ્યાસના ટૂંકા ગાળાના કારણે તે અજ્ઞાત છે કે શું આ ઉપવાસની પદ્ધતિને અટકાવવામાં આવી છે અથવા ફક્ત વિલંબ થયો છે.
તેથી, જોખમી પરિબળો પર એફએમડીની અસર પરના ક્લિનિકલ ડેટા સાથે પ્રીક્લિનિકલ અભ્યાસના આશાસ્પદ પરિણામો
ઓન્કોલોજીમાં ક્લિનિકલ એપ્લિકેબિલિટી
કીમોથેરાપી લઈ રહેલા દર્દીઓમાં ઉપવાસ અને એફએમડીના ચાર સંભવિત અભ્યાસ આજે 52,53,58,61 સુધી પ્રકાશિત કરવામાં આવ્યા છે. સ્તન, પ્રોસ્ટેટ, અંડાશય, ગર્ભાશય, ફેફસા અને અન્નનળીના કેન્સર સહિત વિવિધ પ્રકારના કેન્સરનું નિદાન કરાયેલા 10 દર્દીઓની શ્રેણીમાં, જેમણે સ્વૈચ્છિક રીતે કીમોથેરાપીના 140 કલાક પહેલા અને/અથવા 56 કલાક સુધી ઉપવાસ કર્યો હતો, તેની કોઈ મોટી આડઅસર થઈ નથી. ભૂખ અને માથાકૂટ સિવાયના અન્ય ઉપવાસ દ્વારા જાણ કરવામાં આવી હતી58. તે દર્દીઓ (છ) જેમણે ઉપવાસ સાથે અને વગર કીમોથેરાપી લીધી હતી, તેઓએ ઉપવાસ દરમિયાન થાક, નબળાઇ અને જઠરાંત્રિય પ્રતિકૂળ ઘટનાઓમાં નોંધપાત્ર ઘટાડો નોંધ્યો હતો. વધુમાં, જે દર્દીઓમાં કેન્સરની પ્રગતિનું મૂલ્યાંકન કરી શકાય છે, ઉપવાસ કરવાથી કીમોથેરાપી-પ્રેરિત ગાંઠની માત્રામાં અથવા ટ્યુમર માર્કર્સમાં ઘટાડો થતો નથી. અન્ય એક અભ્યાસમાં, HER13 (જેને ERBB2 તરીકે પણ ઓળખાય છે) નેગેટિવ, સ્ટેજ II/III સ્તન કેન્સર ધરાવતી 2 સ્ત્રીઓને નિયો-એડજુવન્ટ ટેક્સોટેર, એડ્રિયામિસિન અને સાયક્લોફોસ્ફેમાઇડ (ટીએસી) કિમોથેરાપી કેમોથેરાપીની શરૂઆત પહેલાં અને પછી 24 કલાક પહેલાં (ફક્ત પાણી) માટે રેન્ડમાઇઝ્ડ કરવામાં આવી હતી. માનક માર્ગદર્શિકાઓ અનુસાર પોષણ માટે 52.
ટૂંકા ગાળાના ઉપવાસને સારી રીતે સહન કરવામાં આવ્યું હતું અને કીમોથેરાપીના 7 દિવસ પછી સરેરાશ એરિથ્રોસાઇટ અને થ્રોમ્બોસાઇટની સંખ્યામાં ઘટાડો થયો હતો. રસપ્રદ વાત એ છે કે, આ અભ્યાસમાં, ઉપવાસ ન કરનારા દર્દીઓના લ્યુકોસાઈટ્સમાં કીમોથેરાપી પછી 2 મિનિટ પછી ?-H30AX (ડીએનએ નુકસાનનું માર્કર) નું સ્તર વધ્યું હતું પરંતુ ઉપવાસ કરનારા દર્દીઓમાં નહીં. પ્લેટિનમ-આધારિત કીમોથેરાપીથી પસાર થતા દર્દીઓમાં ઉપવાસની માત્રામાં વધારો કરવા માટે, 20 દર્દીઓ (જેને પ્રાથમિક રીતે યુરોથેલિયલ, અંડાશય અથવા સ્તન કેન્સર માટે સારવાર આપવામાં આવી હતી) ને 24, 48 અથવા 72 કલાક માટે ઉપવાસ કરવા માટે રેન્ડમાઇઝ કરવામાં આવ્યા હતા (કેમોથેરાપીના 48 કલાક પહેલા અને કીમોથેરાપી પછી 24 કલાક તરીકે વિભાજિત કરવામાં આવ્યા હતા. )53. સંભવિતતા માપદંડો (દરેક સમૂહમાં છ વિષયોમાંથી ત્રણ અથવા વધુ તરીકે વ્યાખ્યાયિત કરવામાં આવે છે? વધારાની ઝેરીતા વિના ઝડપી સમયગાળા દરમિયાન દરરોજ 200kcal) પૂર્ણ થયા હતા. ઉપવાસ સંબંધિત ઝેરી પદાર્થો
ખૂબ જ તાજેતરમાં, સ્તન અથવા અંડાશયના કેન્સરવાળા કુલ 34 દર્દીઓમાં જીવનની ગુણવત્તા અને કીમોથેરાપીની આડઅસરો પર FMD ની અસરોનું મૂલ્યાંકન કરતી રેન્ડમાઇઝ્ડ ક્રોસઓવર ક્લિનિકલ ટ્રાયલ હાથ ધરવામાં આવી હતી. FMD સમાવેશ થાય છે
ક્લિનિકમાં પડકારો
ઓન્કોલોજીમાં સામયિક ઉપવાસ અથવા એફએમડીનો અભ્યાસ ચિંતાઓથી મુક્ત નથી, ખાસ કરીને આ પ્રકારની આહાર પદ્ધતિ કુપોષણ, સાર્કોપેનિયા,
નિષ્કર્ષ
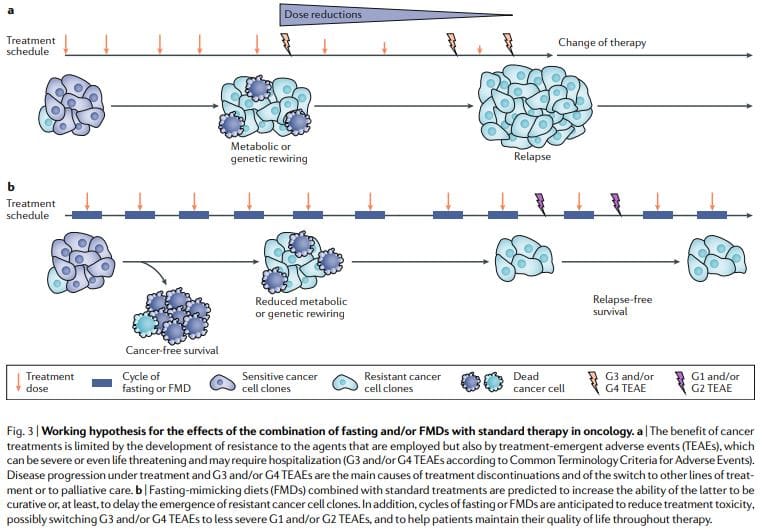
સામયિક ઉપવાસ અથવા FMDs માઉસ કેન્સર મોડલમાં સતત શક્તિશાળી એન્ટિકેન્સર અસરો દર્શાવે છે જેમાં કીમોરાડિયોથેરાપી અને TKI ને સક્ષમ કરવાની ક્ષમતા અને કેન્સર વિરોધી રોગપ્રતિકારક શક્તિને ટ્રિગર કરવાની ક્ષમતાનો સમાવેશ થાય છે. ક્રોનિક ડાયેટરી રેજીમેન્સ કરતાં FMD ચક્ર વધુ શક્ય છે કારણ કે તે દર્દીઓને FMD દરમિયાન નિયમિતપણે ખોરાક લેવાની મંજૂરી આપે છે, ચક્ર વચ્ચે સામાન્ય આહાર જાળવી રાખે છે અને ગંભીર વજનમાં ઘટાડો થતો નથી અને રોગપ્રતિકારક અને અંતઃસ્ત્રાવી પ્રણાલી પર સંભવતઃ હાનિકારક અસરો પેદા કરતી નથી. નોંધપાત્ર રીતે, એકલ ઉપચાર તરીકે, સામયિક ઉપવાસ અથવા FMD ચક્ર કદાચ સ્થાપિત ગાંઠો સામે મર્યાદિત અસરકારકતા બતાવશે. વાસ્તવમાં, ઉંદરમાં, ઉપવાસ અથવા એફએમડી કીમોથેરાપીની જેમ જ સંખ્યાબંધ કેન્સરની પ્રગતિને અસર કરે છે, પરંતુ એકલા, તેઓ ભાગ્યે જ કેન્સરની દવાઓ સાથે સંયોજનમાં મેળવેલી અસર સાથે મેળ ખાય છે જે કેન્સર-મુક્ત અસ્તિત્વ 11,59 માં પરિણમી શકે છે. આમ, અમે દરખાસ્ત કરીએ છીએ કે તે પ્રમાણભૂત સારવાર સાથે સામયિક FMD ચક્રનું સંયોજન છે જે દર્દીઓમાં કેન્સર-મુક્ત જીવન ટકાવી રાખવાની સર્વોચ્ચ સંભાવના ધરાવે છે, જેમ કે માઉસ મોડલ્સ 11,59 (ફિગ. 3) દ્વારા સૂચવવામાં આવ્યું છે.
આ સંયોજન ઘણા કારણોસર ખાસ કરીને બળવાન હોઈ શકે છે: પ્રથમ, કેન્સરની દવાઓ અને અન્ય ઉપચાર અસરકારક હોઈ શકે છે, પરંતુ દર્દીઓનો એક ભાગ પ્રતિસાદ આપતો નથી કારણ કે કેન્સર કોષો વૈકલ્પિક મેટાબોલિક વ્યૂહરચના અપનાવે છે જે અસ્તિત્વ તરફ દોરી જાય છે. ગ્લુકોઝ, અમુક એમિનો એસિડ, હોર્મોન્સ અને વૃદ્ધિના પરિબળો તેમજ કોષ મૃત્યુ તરફ દોરી જતા અન્ય અજાણ્યા માર્ગોમાં ખામીઓ અથવા ફેરફારોને કારણે આ વૈકલ્પિક ચયાપચયની પદ્ધતિઓ ઉપવાસ અથવા FMD પરિસ્થિતિઓમાં ટકાવી રાખવા વધુ મુશ્કેલ છે. બીજું, ઉપવાસ અથવા એફએમડી પ્રતિકાર સંપાદન અટકાવી અથવા ઘટાડી શકે છે. ત્રીજું, ઉપવાસ અથવા એફએમડી સામાન્ય કોષો અને અવયવોને કેન્સરની દવાઓની વિશાળ વિવિધતાને કારણે થતી આડઅસરોથી રક્ષણ આપે છે. શક્યતા, સલામતી અને અસરકારકતાના પૂર્વ-ક્લિનિકલ અને ક્લિનિકલ પુરાવાના આધારે (IGF1, આંતરડાની ચરબી ઘટાડવા પર
તદુપરાંત, ક્રિયાની પદ્ધતિઓની સમજ સાથે FMD ને લાગુ કરવું આવશ્યક છે, કારણ કે તેમની શક્તિ
કેન્સર 63,65�68 ધરાવતા દર્દીઓમાં FMDsના ચાલુ ક્લિનિકલ અભ્યાસો વધુ નક્કર જવાબો આપશે કે શું પરંપરાગત એન્ટિકેન્સર એજન્ટો સાથે સંયોજનમાં સામયિક FMDs સૂચવવાથી પછીની સહનશીલતા અને પ્રવૃત્તિમાં સુધારો કરવામાં મદદ મળે છે. એ ધ્યાનમાં લેવું અગત્યનું છે કે એફએમડી તમામ દર્દીઓમાં કેન્સરની સારવારની આડ અસરોને ઘટાડવામાં અસરકારક રહેશે નહીં અને ન તો તે તમામ ઉપચારની અસરકારકતામાં સુધારો કરવા માટે કામ કરશે, પરંતુ ઓછામાં ઓછા એક ભાગ માટે અને સંભવતઃ તે કરવા માટે તેમની પાસે મોટી સંભાવના છે. દર્દીઓ અને દવાઓના મોટા ભાગ માટે. નબળા અથવા કુપોષિત દર્દીઓ અથવા કુપોષણનું જોખમ ધરાવતા દર્દીઓને ઉપવાસ અથવા એફએમડીના ક્લિનિકલ અભ્યાસમાં નોંધણી કરાવવી જોઈએ નહીં અને ક્લિનિકલ ટ્રાયલ્સ દરમિયાન દર્દીના પોષણની સ્થિતિ અને મંદાગ્નિનું કાળજીપૂર્વક નિરીક્ષણ કરવું જોઈએ.
સંદર્ભ:
"ઉપરની માહિતીઉપવાસ અને કેન્સર: મોલેક્યુલર મિકેનિઝમ્સ અને ક્લિનિકલ એપ્લિકેશન" લાયકાત ધરાવતા હેલ્થકેર પ્રોફેશનલ અથવા લાઇસન્સ પ્રાપ્ત ચિકિત્સક સાથેના એક-એક-એક સંબંધને બદલવાનો હેતુ નથી અને તે તબીબી સલાહ નથી. અમે તમને તમારા સંશોધન અને લાયક આરોગ્યસંભાળ વ્યાવસાયિક સાથે ભાગીદારીના આધારે આરોગ્યસંભાળના નિર્ણયો લેવા પ્રોત્સાહિત કરીએ છીએ.
અમારી માહિતીનો અવકાશ શિરોપ્રેક્ટિક, મસ્ક્યુલોસ્કેલેટલ, શારીરિક દવાઓ, સુખાકારી, યોગદાન આપતી ઇટીઓલોજિકલ સુધી મર્યાદિત છે વિસેરોસોમેટિક વિક્ષેપ ક્લિનિકલ પ્રસ્તુતિઓની અંદર, સંકળાયેલ સોમેટોવિસેરલ રિફ્લેક્સ ક્લિનિકલ ડાયનેમિક્સ, સબલક્સેશન કોમ્પ્લેક્સ, સંવેદનશીલ સ્વાસ્થ્ય સમસ્યાઓ અને/અથવા કાર્યાત્મક દવા લેખો, વિષયો અને ચર્ચાઓ.
અમે પ્રદાન કરીએ છીએ અને પ્રસ્તુત કરીએ છીએ ક્લિનિકલ સહયોગ વિવિધ શાખાઓના નિષ્ણાતો સાથે. દરેક નિષ્ણાત તેમના વ્યવસાયિક પ્રેક્ટિસના અવકાશ અને તેમના લાઇસન્સના અધિકારક્ષેત્ર દ્વારા સંચાલિત થાય છે. અમે મસ્ક્યુલોસ્કેલેટલ સિસ્ટમની ઇજાઓ અથવા વિકૃતિઓ માટે સારવાર અને સહાયક સંભાળ માટે કાર્યાત્મક આરોગ્ય અને સુખાકારી પ્રોટોકોલનો ઉપયોગ કરીએ છીએ.
અમારા વિડિયો, પોસ્ટ્સ, વિષયો, વિષયો અને આંતરદૃષ્ટિ ક્લિનિકલ બાબતો, મુદ્દાઓ અને વિષયોને આવરી લે છે જે અમારી પ્રેક્ટિસના ક્લિનિકલ અવકાશ સાથે સંબંધિત અને પ્રત્યક્ષ કે પરોક્ષ રીતે સપોર્ટ કરે છે.*
અમારી ઑફિસે સહાયક અવતરણો પ્રદાન કરવાનો વ્યાજબી પ્રયાસ કર્યો છે અને અમારી પોસ્ટ્સને સમર્થન આપતા સંબંધિત સંશોધન અભ્યાસ અથવા અભ્યાસોને ઓળખ્યા છે. વિનંતી પર અમે નિયમનકારી બોર્ડ અને જનતા માટે ઉપલબ્ધ સહાયક સંશોધન અધ્યયનની નકલો પ્રદાન કરીએ છીએ.
અમે સમજીએ છીએ કે અમે એવી બાબતોને આવરી લઈએ છીએ કે જેના માટે કોઈ વિશેષ સમજૂતી યોજના અથવા સારવાર પ્રોટોકોલમાં તે કેવી રીતે સહાય કરી શકે તેના વધારાના સમજૂતીની જરૂર પડે છે; તેથી, ઉપરના વિષયના વિષય પર વધુ ચર્ચા કરવા માટે, કૃપા કરીને પૂછવા માટે મફત લાગે ડૉ. એલેક્સ જિમેનેઝ, ડીસી, અથવા અમને સંપર્ક કરો 915-850-0900.
અમે તમને અને તમારા પરિવારની મદદ માટે અહીં છીએ.
આશીર્વાદ
ડૉ. એલેક્સ જિમેનેઝ ડીસી, એમ.એસ.એ.સી.પી., RN*, સી.સી.એસ.ટી., આઈએફએમસીપી*, CIFM*, એટીએન*
ઇમેઇલ: કોચ
માં ચિરોપ્રેક્ટિક (ડીસી) ના ડૉક્ટર તરીકે લાઇસન્સ ટેક્સાસ & ન્યૂ મેક્સિકો*
ટેક્સાસ ડીસી લાઇસન્સ # TX5807, ન્યુ મેક્સિકો ડીસી લાઇસન્સ # NM-DC2182
રજિસ્ટર્ડ નર્સ (RN*) તરીકે લાઇસન્સ પ્રાપ્ત in ફ્લોરિડા
ફ્લોરિડા લાયસન્સ આરએન લાયસન્સ # RN9617241 (નિયંત્રણ નં. 3558029)
કોમ્પેક્ટ સ્થિતિ: મલ્ટી-સ્ટેટ લાઇસન્સ: માં પ્રેક્ટિસ કરવા માટે અધિકૃત 40 સ્ટેટ્સ*
ડૉ. એલેક્સ જિમેનેઝ ડીસી, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
માય ડિજિટલ બિઝનેસ કાર્ડ