કેટોન બોડી યકૃત દ્વારા બનાવવામાં આવે છે અને જ્યારે માનવ શરીરમાં ગ્લુકોઝ સહેલાઈથી ઉપલબ્ધ ન હોય ત્યારે તેનો ઉર્જા સ્ત્રોત તરીકે ઉપયોગ થાય છે. બે મુખ્ય કીટોન બોડી એસીટોએસેટેટ (એસીએસી) અને 3-બીટા-હાઈડ્રોક્સીબ્યુટાયરેટ (3એચબી) છે, જ્યારે એસીટોન એ ત્રીજું અને સૌથી ઓછું વિપુલ, કેટોન બોડી છે. કીટોન હંમેશા લોહીમાં હાજર હોય છે અને ઉપવાસ અને લાંબી કસરત દરમિયાન તેનું સ્તર વધે છેકેટોજેનેસિસ એ બાયોકેમિકલ પ્રક્રિયા છે જેના દ્વારા સજીવો ફેટી એસિડ અને કેટોજેનિક એમિનો એસિડના ભંગાણ દ્વારા કેટોન બોડી બનાવે છે.
કેટોન બોડી મુખ્યત્વે માં પેદા થાય છે યકૃત કોશિકાઓના મિટોકોન્ડ્રિયા. કેટોજેનેસિસ ત્યારે થાય છે જ્યારે લોહીમાં ગ્લુકોઝનું સ્તર ઓછું હોય, ખાસ કરીને અન્ય સેલ્યુલર કાર્બોહાઇડ્રેટ સ્ટોર્સ, જેમ કે ગ્લાયકોજેન, ખલાસ થઈ ગયા પછી. જ્યારે ઇન્સ્યુલિનની અપૂરતી માત્રા હોય ત્યારે પણ આ પદ્ધતિ આવી શકે છે. કેટોન બોડીનું ઉત્પાદન આખરે ઊર્જા ઉપલબ્ધ કરાવવા માટે શરૂ કરવામાં આવે છે જે માનવ શરીરમાં ફેટી એસિડ તરીકે સંગ્રહિત થાય છે. કેટોજેનેસિસ મિટોકોન્ડ્રિયામાં થાય છે જ્યાં તે સ્વતંત્ર રીતે નિયંત્રિત થાય છે.
અનુક્રમણિકા
અમૂર્ત
કેટોન બોડી મેટાબોલિઝમ એ ફિઝિયોલોજિકલ હોમિયોસ્ટેસિસમાં કેન્દ્રિય નોડ છે. આ સમીક્ષામાં, અમે ચર્ચા કરીએ છીએ કે કેવી રીતે કીટોન્સ અલગ-અલગ ફાઇન-ટ્યુનિંગ મેટાબોલિક ભૂમિકાઓ પ્રદાન કરે છે જે વિવિધ પોષક તત્ત્વોના અવશેષોમાં અંગ અને જીવતંત્રની કામગીરીને શ્રેષ્ઠ બનાવે છે અને બહુવિધ અંગ પ્રણાલીઓમાં બળતરા અને ઇજાઓથી રક્ષણ આપે છે. પરંપરાગત રીતે મેટાબોલિક સબસ્ટ્રેટ્સ તરીકે જોવામાં આવે છે જે ફક્ત કાર્બોહાઇડ્રેટ પ્રતિબંધમાં નોંધાયેલ છે, તાજેતરના અવલોકનો કાર્બોહાઇડ્રેટ્સ વિપુલ પ્રમાણમાં હોય ત્યારે મહત્વપૂર્ણ ચયાપચય અને સિગ્નલિંગ મધ્યસ્થીઓ તરીકે કીટોન બોડીના મહત્વને રેખાંકિત કરે છે. નર્વસ સિસ્ટમના રોગો માટે જાણીતા રોગનિવારક વિકલ્પોના ભંડારને પૂરક બનાવતા, કેન્સરમાં કેટોન બોડીઝ માટે સંભવિત ભૂમિકાઓ ઊભી થઈ છે, જેમ કે હૃદય અને યકૃતમાં રસપ્રદ રક્ષણાત્મક ભૂમિકાઓ છે, સ્થૂળતા-સંબંધિત અને રક્તવાહિની રોગમાં ઉપચારાત્મક વિકલ્પો ખોલ્યા છે. કેટોન મેટાબોલિઝમ અને સિગ્નલિંગમાં વિવાદોની ચર્ચા સમકાલીન અવલોકનો સાથે શાસ્ત્રીય અંધવિશ્વાસના સમાધાન માટે કરવામાં આવે છે.
પરિચય
કેટોન બોડી એ જીવનના તમામ ડોમેન્સ, યુકેરિયા, બેક્ટેરિયા અને આર્કિઆ (અનેજા એટ અલ., 2002; કાહિલ જીએફ જુનિયર, 2006; કૃષ્ણકુમાર એટ અલ., 2008) માટે એક મહત્વપૂર્ણ વૈકલ્પિક મેટાબોલિક ઇંધણ સ્ત્રોત છે. પોષક તત્ત્વોના અભાવના એપિસોડિક સમયગાળા દરમિયાન મગજને બળતણ આપવા માટે માનવોમાં કેટોન બોડી મેટાબોલિઝમનો લાભ લેવામાં આવ્યો છે. કેટોન બોડી નિર્ણાયક સસ્તન પ્રાણીઓના ચયાપચયના માર્ગો જેમ કે ?-ઓક્સિડેશન (FAO), ટ્રાઇકાર્બોક્સિલિક એસિડ સાયકલ (TCA), ગ્લુકોનોજેનેસિસ, ડી નોવો લિપોજેનેસિસ (DNL), અને સ્ટીરોલ્સના જૈવસંશ્લેષણ સાથે વણાયેલા છે. સસ્તન પ્રાણીઓમાં, કીટોન બોડી મુખ્યત્વે યકૃતમાં FAO-પ્રાપ્ત એસિટિલ-CoA માંથી ઉત્પન્ન થાય છે, અને તેમને ટર્મિનલ ઓક્સિડેશન માટે એક્સ્ટ્રાહેપેટિક પેશીઓમાં પરિવહન કરવામાં આવે છે. આ શરીરવિજ્ઞાન વૈકલ્પિક બળતણ પૂરું પાડે છે જે ઉપવાસના પ્રમાણમાં ટૂંકા ગાળા દ્વારા વધે છે, જે ફેટી એસિડની ઉપલબ્ધતામાં વધારો કરે છે અને કાર્બોહાઇડ્રેટની ઉપલબ્ધતાને ઘટાડે છે (કાહિલ જીએફ જુનિયર, 2006; મેકગેરી અને ફોસ્ટર, 1980; રોબિન્સન અને વિલિયમસન, 1980). ઉપવાસ, ભૂખમરો, નવજાત અવધિ, વ્યાયામ પછી, ગર્ભાવસ્થા અને ઓછા કાર્બોહાઇડ્રેટ આહારનું પાલન સહિત અસંખ્ય શારીરિક અવસ્થાઓમાં એક્સ્ટ્રાહેપેટિક પેશીઓમાં એકંદર ઊર્જા સસ્તન પ્રાણીઓના ચયાપચયમાં કેટોન બોડી ઓક્સિડેશન નોંધપાત્ર ફાળો આપે છે. સ્વસ્થ પુખ્ત માનવીઓમાં કુલ કેટોન બોડી સાંદ્રતાનું પરિભ્રમણ સામાન્ય રીતે આશરે 100�250 �M ની વચ્ચે સર્કેડિયન ઓસિલેશન દર્શાવે છે, લાંબી કસરત અથવા 1 કલાકના ઉપવાસ પછી ~24 mM સુધી વધે છે અને ડાયાબિટીક (ડાયાબિટીક) જેવા રોગવિજ્ઞાનવિષયક સ્થિતિઓમાં 20 એમએમ સુધી એકઠા થઈ શકે છે. કાહિલ જીએફ જુનિયર, 2006; જોન્સન એટ અલ., 1969બી; કોસ્લાગ એટ અલ., 1980; રોબિન્સન અને વિલિયમસન, 1980; વિલ્ડનહોફ એટ અલ., 1974). માનવ યકૃત દરરોજ 300 ગ્રામ સુધી કેટોન બોડી ઉત્પન્ન કરે છે (બાલાસે અને ફેરી, 1989), જે ખોરાક, ઉપવાસ અને ભૂખમરો રાજ્યોમાં કુલ ઊર્જા ખર્ચના 5�20% વચ્ચે ફાળો આપે છે (બાલાસે એટ અલ., 1978; કોક્સ એટ al., 2016).
તાજેતરના અભ્યાસો હવે સસ્તન પ્રાણીઓના કોષ ચયાપચય, હોમિયોસ્ટેસિસ અને વિવિધ પ્રકારની શારીરિક અને રોગવિજ્ઞાનવિષયક અવસ્થાઓ હેઠળ સિગ્નલિંગમાં કેટોન બોડી માટે અનિવાર્ય ભૂમિકાઓને પ્રકાશિત કરે છે. મગજ, હૃદય અથવા હાડપિંજરના સ્નાયુઓ જેવા એક્સ્ટ્રાહેપેટિક પેશીઓ માટે ઉર્જા ઇંધણ તરીકે સેવા આપવા ઉપરાંત, કીટોન બોડી સિગ્નલિંગ મિડિએટર્સ, પ્રોટીન પોસ્ટ-ટ્રાન્સલેશનલ મોડિફિકેશન (PTM) અને બળતરા અને ઓક્સિડેટીવ સ્ટ્રેસના મોડ્યુલેટર તરીકે મહત્ત્વની ભૂમિકા ભજવે છે. આ સમીક્ષામાં, અમે કેટોન બોડીની પ્લેયોટ્રોપિક ભૂમિકાઓ અને તેમના ચયાપચયના ક્લાસિકલ અને આધુનિક બંને મંતવ્યો પ્રદાન કરીએ છીએ.
કેટોન બોડી મેટાબોલિઝમની ઝાંખી
હેપેટિક કેટોજેનેસિસનો દર ચરબીના શારીરિક અને બાયોકેમિકલ પરિવર્તનની શ્રેણીબદ્ધ શ્રેણી દ્વારા સંચાલિત થાય છે. પ્રાથમિક નિયમનકારોમાં ટ્રાયસીલગ્લિસેરોલ્સમાંથી ફેટી એસિડ્સનું લિપોલીસીસ, હેપેટોસાઇટ પ્લાઝ્મા મેમ્બ્રેનમાં અને તેની આરપાર પરિવહન, કાર્નેટીન પાલ્મિટોયલટ્રાન્સફેરેઝ 1 (સીપીટી1) દ્વારા મિટોકોન્ડ્રિયામાં પરિવહન, ?-ઓક્સિડેશન સર્પાકાર, TCA ચક્ર પ્રવૃત્તિ અને મધ્યવર્તી સાંદ્રતા, સંભવિત રેડિયોલોજીકલ રેગ્યુલેટર્સનો સમાવેશ થાય છે. આ પ્રક્રિયાઓમાં મુખ્યત્વે ગ્લુકોગન અને ઇન્સ્યુલિન [એરિયાસ એટ અલ., 1995; આઇટે એટ અલ., 1993; એહારા એટ અલ., 2015; ફેરે એટ અલ., 1983; કાહ્ન એટ અલ., 2005; મેકગેરી અને ફોસ્ટર , 1980; વિલિયમસન એટ અલ., 1969)]. ક્લાસિકલી કેટોજેનેસિસને સ્પિલઓવર પાથવે તરીકે જોવામાં આવે છે, જેમાં ?-ઓક્સિડેશન-વ્યુત્પન્ન એસિટિલ-CoA સાઇટ્રેટ સિન્થેઝ પ્રવૃત્તિ અને/અથવા ઓક્સાલોએસેટેટની ઉપલબ્ધતાને સાઇટ્રેટ બનાવવા માટે ઘનીકરણ કરતાં વધી જાય છે. થ્રી-કાર્બન મધ્યવર્તી એન્ટિ-કેટોજેનિક પ્રવૃત્તિ પ્રદર્શિત કરે છે, સંભવતઃ એસિટિલ-CoA વપરાશ માટે ઓક્સાલોએસેટેટ પૂલને વિસ્તૃત કરવાની તેમની ક્ષમતાને કારણે, પરંતુ એકલા યકૃતમાં એસિટિલ-CoA સાંદ્રતા કેટોજેનિક દર નક્કી કરતી નથી (ફોસ્ટર, 1967; રાવત અને મેનાહન, 1975 વિલિયમ્સન; એટ અલ., 1969). હોર્મોનલ, ટ્રાન્સક્રિપ્શનલ અને પોસ્ટ-ટ્રાન્સલેશનલ ઘટનાઓ દ્વારા કેટોજેનેસિસનું નિયમન એકસાથે આ ધારણાને સમર્થન આપે છે કે કેટોજેનિક દરને ફાઇન-ટ્યુન કરતી મોલેક્યુલર મિકેનિઝમ્સ અપૂર્ણ રીતે સમજી શકાય છે (HMGCS2 અને SCOT/OXCT1નું નિયમન જુઓ).
કેટોજેનેસિસ મુખ્યત્વે હિપેટિક મિટોકોન્ડ્રીયલ મેટ્રિક્સમાં કુલ ચરબીના ઓક્સિડેશનના પ્રમાણસર થાય છે. મિટોકોન્ડ્રીયલ મેમ્બ્રેન પર એસિલ સાંકળોના પરિવહન અને ?-ઓક્સિડેશન પછી, 3-હાઈડ્રોક્સિમેથિલગ્લુટેરીલ-CoA સિન્થેઝ (HMGCS2) નું મિટોકોન્ડ્રીયલ આઈસોફોર્મ એસીટોએસેટિલ-CoA (AcAc-CoA) અને એચટીએલજેન-એસેટીલ-કોએ (AcAc-CoA) ના ઘનીકરણને ઉત્પ્રેરિત કરે છે. (ફિગ. 1A). HMG-CoA lyase (HMGCL) એસીટીલ-CoA અને એસીટોએસેટેટ (AcAc) ને મુક્ત કરવા માટે HMG-CoA ને કાપી નાખે છે, અને બાદમાં ફોસ્ફેટીડીલ્કોલાઇન-આશ્રિત મિટોકોન્ડ્રીયલ ડી-?OHB (D-OHB) દ્વારા d-?-hydroxybutyrate (d-?OHB) માં ઘટાડો થાય છે. BDH1) એનએડી+/એનએડીએચ-યુગલ નજીક-સંતુલન પ્રતિક્રિયામાં (બોક અને ફ્લીશર, 1975; લેહનિંગર એટ અલ., 1960). BDH1 સંતુલન સતત d-?OHB ઉત્પાદનની તરફેણ કરે છે, પરંતુ AcAc/d-?OHB કીટોન બોડીનો ગુણોત્તર માઇટોકોન્ડ્રીયલ NAD+/NADH ગુણોત્તર સાથે સીધો પ્રમાણસર છે, અને આમ BDH1 ઓક્સિડોરેડક્ટેઝ પ્રવૃત્તિ મિટોકોન્ડ્રીયલ રેડોક્સેટ 1969 પોટેન્શિયલ; વિલિયમસન એટ અલ., 1967). કેટોએસિડોસિસ (એટલે કે, કુલ સીરમ કેટોન બોડીઝ > ~1929 એમએમ; AcAc pKa 7, ?OHB pKa 3.6) પીડિત મનુષ્યોમાં મીઠી ગંધનો સ્ત્રોત એસીટોન (પેડરસન, 4.7) ને AcAc સ્વયંભૂ રીતે ડીકાર્બોક્સિલેટ કરી શકે છે. મિટોકોન્ડ્રીયલ આંતરિક પટલમાં કેટોન બોડીનું પરિવહન કઈ પદ્ધતિ દ્વારા થાય છે તે જાણી શકાયું નથી, પરંતુ AcAc/d-?OHB કોષોમાંથી મોનોકાર્બોક્સિલેટ ટ્રાન્સપોર્ટર્સ (સસ્તન પ્રાણીઓમાં, MCT 1 અને 2, જેને દ્રાવ્ય વાહક તરીકે પણ ઓળખવામાં આવે છે 16A કુટુંબના સભ્યો 1 અને 7) અને ટર્મિનલ ઓક્સિડેશન માટે એક્સ્ટ્રાહેપેટિક પેશીઓમાં પરિભ્રમણમાં પરિવહન (કોટર એટ અલ., 2011; હેલેસ્ટ્રેપ અને વિલ્સન, 2012; હેલેસ્ટ્રેપ, 2012; હ્યુગો એટ અલ., 2012). પરિભ્રમણ કરતા કેટોન બોડીની સાંદ્રતા એક્સ્ટ્રાહેપેટિક પેશીઓ (હેરીસન અને લોંગ, 1940) કરતા વધારે છે જે દર્શાવે છે કે કેટોન બોડી એક સાંદ્રતા ઢાળ નીચે વહન કરવામાં આવે છે. MCT1 માં કાર્યની ખોટ પરિવર્તનો કેટોએસિડોસિસના સ્વયંસ્ફુરિત હુમલાઓ સાથે સંકળાયેલા છે, જે કેટોન બોડીની આયાતમાં નિર્ણાયક ભૂમિકા સૂચવે છે.
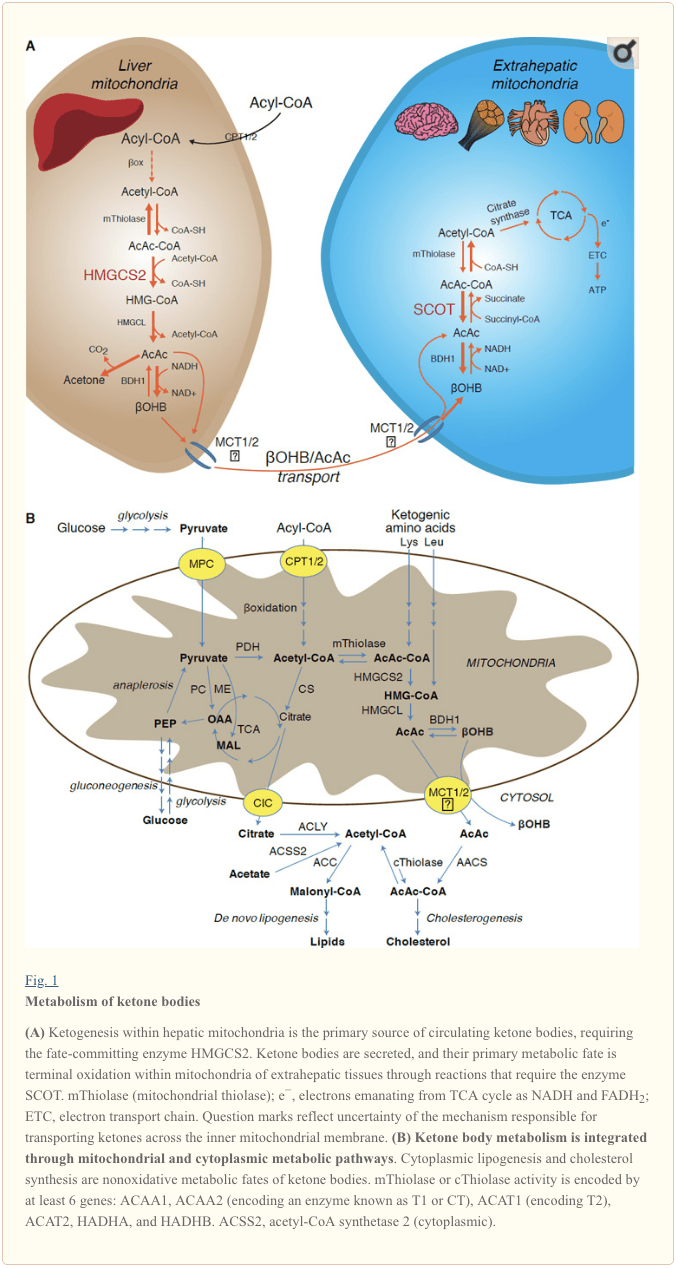
� કેટોન બોડીના બિન-ઓક્સિડેટીવ ફેટ્સમાં સંભવિત ડાયવર્ઝનને બાદ કરતાં (કેટોન બોડીઝના નોન-ઓક્સિડેટીવ મેટાબોલિક ફેટ્સ જુઓ), હેપેટોસાયટ્સમાં તેમના દ્વારા ઉત્પાદિત કેટોન બોડીઝને ચયાપચય કરવાની ક્ષમતાનો અભાવ હોય છે. યકૃત દ્વારા સંશ્લેષિત ડી નોવો કેટોન બોડીઝ (i) એક્સ્ટ્રાહેપેટિક પેશીઓના મિટોકોન્ડ્રિયામાં એસિટિલ-કોએમાં અપચયિત થાય છે, જે ટર્મિનલ ઓક્સિડેશન (ફિગ. 1A) માટે TCA ચક્ર માટે ઉપલબ્ધ છે, (ii) લિપોજેનેસિસ અથવા સ્ટીરોલ સંશ્લેષણ માર્ગો તરફ વાળવામાં આવે છે. ફિગ. 1B), અથવા (iii) પેશાબમાં વિસર્જન. વૈકલ્પિક ઊર્જાસભર બળતણ તરીકે, કેટોન બોડી હૃદય, હાડપિંજરના સ્નાયુઓ અને મગજમાં ઉત્સુક રીતે ઓક્સિડાઇઝ થાય છે (બાલાસે અને ફેરી, 1989; બેન્ટૌર્કિયા એટ અલ., 2009; ઓવેન એટ અલ., 1967; રીચાર્ડ એટ અલ., 1974; સુલતાન, 1988 ). એક્સ્ટ્રાહેપેટિક મિટોકોન્ડ્રીયલ BDH1 ?OHB ઓક્સિડેશનની પ્રથમ પ્રતિક્રિયાને ઉત્પ્રેરક કરે છે, તેને બેક AcAc (LEHNINGER et al., 1960; Sandermann et al., 1986) માં રૂપાંતરિત કરે છે. BDH2 માટે માત્ર 20% ક્રમ ઓળખ સાથે સાયટોપ્લાઝમિક d-?OHB-ડિહાઈડ્રોજેનેઝ (BDH1) કેટોન બોડી માટે ઉચ્ચ કિમી ધરાવે છે, અને આયર્ન હોમિયોસ્ટેસિસમાં પણ ભૂમિકા ભજવે છે (દાવુલુરી એટ અલ., 2016; ગુઓ એટ અલ., 2006) . એક્સ્ટ્રાહેપેટિક માઇટોકોન્ડ્રીયલ મેટ્રિક્સમાં, AcAc એ એક અનન્ય સસ્તન પ્રાણી CoA ટ્રાન્સફરસે, succinyl-CoA:3-oxoacid-CoA ટ્રાન્સફરસે (SCOT, CoA ટ્રાન્સફરસેસ; OXCT1 દ્વારા એન્કોડેડ), નજીકના સંતુલન પ્રતિક્રિયા દ્વારા. AcAc-CoA ના જલવિચ્છેદન દ્વારા મુક્ત થતી ઉર્જા સક્સીનિલ-CoA કરતા વધારે છે, જે AcAc રચનાની તરફેણ કરે છે. આમ કેટોન બોડી ઓક્સિડેટીવ પ્રવાહ સામૂહિક ક્રિયાને કારણે થાય છે: AcAc નો વિપુલ પુરવઠો અને સાઇટ્રેટ સિન્થેઝ દ્વારા એસિટિલ-CoA નો ઝડપી વપરાશ SCOT દ્વારા AcAc-CoA (+ સસીનેટ) રચનાની તરફેણ કરે છે. નોંધનીય રીતે, ગ્લુકોઝ (હેક્સોકિનેઝ) અને ફેટી એસિડ્સ (એસિલ-કોએ સિન્થેટેસેસ) થી વિપરીત, ઓક્સિડાઇઝેબલ સ્વરૂપમાં કેટોન બોડીઝ (SCOT) ના સક્રિયકરણ માટે ATP ના રોકાણની જરૂર નથી. ઉલટાવી શકાય તેવી AcAc-CoA થિયોલેઝ પ્રતિક્રિયા [ACAA2 (T1 અથવા CT તરીકે ઓળખાતા એન્ઝાઇમનું એન્કોડિંગ), ACAT1 (એનકોડિંગ T2), HADHA, અથવા HADHB દ્વારા એન્કોડ કરાયેલા ચાર મિટોકોન્ડ્રીયલ થિયોલેસમાંથી કોઈપણ દ્વારા ઉત્પ્રેરિત] એસીટીલ-કોએના બે અણુઓ ઉત્પન્ન કરે છે. જે TCA ચક્રમાં પ્રવેશ કરે છે (હર્ષ અને જેન્ક્સ, 1967; સ્ટર્ન એટ અલ., 1956; વિલિયમસન એટ અલ., 1971). કેટોટિક અવસ્થાઓ દરમિયાન (એટલે કે, કુલ સીરમ કીટોન્સ > 500 �M), કેટોન બોડી ઊર્જા ખર્ચમાં નોંધપાત્ર ફાળો આપનાર બની જાય છે ; એડમંડ એટ અલ., 1978). યકૃતમાંથી મેળવેલા કીટોન બોડીનો ખૂબ જ નાનો અંશ પેશાબમાં સરળતાથી માપી શકાય છે, અને કિડની દ્વારા ઉપયોગ અને પુનઃશોષણ દરો પરિભ્રમણ સાંદ્રતાના પ્રમાણમાં છે (ગોલ્ડસ્ટેઇન, 1989; રોબિન્સન અને વિલિયમસન, 1987). અત્યંત કીટોટિક અવસ્થાઓ (> પ્લાઝ્મામાં 1987 એમએમ) દરમિયાન, કેટોન્યુરિયા કીટોસિસના અર્ધ-માત્રાત્મક રિપોર્ટર તરીકે કામ કરે છે, જો કે પેશાબના કીટોન બોડીના મોટાભાગના ક્લિનિકલ એસેસ AcAc શોધે છે પરંતુ ?OHB (ક્લોકર એટ અલ., 1980) નથી.
કેટોજેનિક સબસ્ટ્રેટ્સ અને હેપેટોસાઇટ મેટાબોલિઝમ પર તેમની અસર
કેટોજેનિક સબસ્ટ્રેટ્સમાં ફેટી એસિડ અને એમિનો એસિડ (ફિગ. 1B) નો સમાવેશ થાય છે. એમિનો એસિડનું અપચય, ખાસ કરીને લ્યુસીન, શોષણ પછીની અવસ્થામાં લગભગ 4% કીટોન બોડી પેદા કરે છે (થોમસ એટ અલ., 1982). આમ કેટોન બોડી બનાવવા માટે એસિટિલ-કોએ સબસ્ટ્રેટ પૂલ મુખ્યત્વે ફેટી એસિડ્સમાંથી મેળવે છે, કારણ કે કાર્બોહાઇડ્રેટ સપ્લાયમાં ઘટાડો થવાની સ્થિતિમાં, પાયરુવેટ મુખ્યત્વે એનાપ્લેરોસિસ દ્વારા હેપેટિક TCA ચક્રમાં પ્રવેશે છે, એટલે કે, એટીપી-આધારિત કાર્બોક્સિલેશનથી ઓક્સાલોએસેટ (ઓક્સાલોસેટ) (MAL), અને એસીટીલ-CoA માટે ઓક્સિડેટીવ ડીકાર્બોક્સિલેશન નહીં (Jeoung et al., 2012; Magnusson et al., 1991; Merritt et al., 2011). યકૃતમાં, ગ્લુકોઝ અને પાયરુવેટ કેટોજેનેસિસમાં નજીવું યોગદાન આપે છે, જ્યારે એસીટીલ-કોએમાં પાયરુવેટ ડીકાર્બોક્સિલેશન મહત્તમ હોય ત્યારે પણ (જેઓંગ એટ અલ., 2012).
એસીટીલ-કોએ એટીપી જનરેશનની બહાર ટર્મિનલ ઓક્સિડેશન દ્વારા હિપેટિક મધ્યસ્થી ચયાપચયની અભિન્ન ભૂમિકાઓને સમાવે છે (કેટોન બોડી મેટાબોલિઝમ, પોસ્ટ-ટ્રાન્સલેશનલ મોડિફિકેશન, અને સેલ ફિઝિયોલોજી પણ જુઓ). Acetyl-CoA એલોસ્ટેરીલી સક્રિય કરે છે (i) પાયરુવેટ કાર્બોક્સિલેઝ (PC), ત્યાં મેટાબોલિક કંટ્રોલ મિકેનિઝમ સક્રિય કરે છે જે TCA ચક્ર (ઓવેન એટ અલ., 2002; સ્ક્રુટન અને યુટર, 1967) અને (ડીહાઈડ્રોજેન) માં ચયાપચયના એનાપ્લેરોટિક પ્રવેશને વધારે છે. કિનાઝ, જે ફોસ્ફોરીલેટ કરે છે અને પાયરુવેટ ડિહાઈડ્રોજેનેઝ (PDH) (કૂપર એટ અલ., 1975) ને અટકાવે છે, ત્યાં એનાપ્લેરોસિસ દ્વારા TCA ચક્રમાં પાયરુવેટના પ્રવાહને વધુ વધારશે. વધુમાં, સાયટોપ્લાઝમિક એસિટિલ-કોએ, જેનો પૂલ મિટોકોન્ડ્રીયલ એસિટિલ-કોએને પરિવહનક્ષમ ચયાપચયમાં રૂપાંતરિત કરતી પદ્ધતિઓ દ્વારા વિસ્તૃત છે, તે ફેટી એસિડ ઓક્સિડેશનને અટકાવે છે: એસિટિલ-કોએ કાર્બોક્સિલેઝ (એસીસી) એસીટીલ-કોએના રૂપાંતરણને ઉત્પ્રેરક કરે છે. અને મિટોકોન્ડ્રીયલ CPT1 ના એલોસ્ટેરિક અવરોધક [(કાહ્ન એટ અલ., 2005; મેકગેરી અને ફોસ્ટર, 1980) માં સમીક્ષા કરવામાં આવી છે. આમ, મિટોકોન્ડ્રીયલ એસીટીલ-કોએ પૂલ બંનેને નિયમન કરે છે અને કેટોજેનેસિસના સ્પીલોવર પાથવે દ્વારા નિયંત્રિત થાય છે, જે હેપેટિક મધ્યસ્થી ચયાપચયના મુખ્ય પાસાઓનું આયોજન કરે છે.
કેટોન બોડીઝના નોન-ઓક્સિડેટીવ મેટાબોલિક ફેટ્સ
યકૃતમાંથી મેળવેલા કીટોન્સનું મુખ્ય ભાગ્ય SCOT-આશ્રિત એક્સ્ટ્રાહેપેટિક ઓક્સિડેશન છે. જો કે, AcAc ને મિટોકોન્ડ્રિયામાંથી નિકાસ કરી શકાય છે અને સાયટોપ્લાઝમિક એસેટોએસેટિલ-CoA સિન્થેટેઝ (AACS, Fig. 1B) દ્વારા ઉત્પ્રેરિત એટીપી-આશ્રિત પ્રતિક્રિયા દ્વારા AcAc-CoA માં રૂપાંતર દ્વારા એનાબોલિક માર્ગોમાં ઉપયોગ કરી શકાય છે. આ માર્ગ મગજના વિકાસ દરમિયાન અને સ્તનપાન કરાવતી સ્તનધારી ગ્રંથિમાં સક્રિય છે (મોરિસ, 2005; રોબિન્સન અને વિલિયમસન, 1978; ઓહગામી એટ અલ., 2003). એએસીએસ એડીપોઝ પેશીઓ અને સક્રિય ઓસ્ટિઓક્લાસ્ટ્સમાં પણ ખૂબ જ વ્યક્ત થાય છે (એગ્યુલો એટ અલ., 2010; યામાસાકી એટ અલ., 2016). સાયટોપ્લાઝમિક AcAc-CoA ને સાયટોસોલિક HMGCS1 દ્વારા સ્ટેરોલ જૈવસંશ્લેષણ તરફ નિર્દેશિત કરી શકાય છે, અથવા બે સાયટોપ્લાઝમિક થિયોલેસેસ દ્વારા એસીટીલ-CoA (ACAA1 અને ACAT2) દ્વારા ક્લીવ કરી શકાય છે, મેલોનીલ-CoA માં કાર્બોક્સિલેટેડ, અને ફેટી એસીડ (ફેટી એસિડ) ના સંશ્લેષણમાં ફાળો આપે છે. અલ., 1984; એડમંડ, 1974; એન્ડેમેન એટ અલ., 1982; ગીલેન એટ અલ., 1983; વેબર અને એડમંડ, 1977).
જ્યારે શારીરિક મહત્વ હજી સ્થાપિત થવાનું બાકી છે, ત્યારે કીટોન્સ યકૃતમાં પણ એનાબોલિક સબસ્ટ્રેટ તરીકે સેવા આપી શકે છે. કૃત્રિમ પ્રાયોગિક સંદર્ભોમાં, AcAc નવા સંશ્લેષિત લિપિડના અડધા જેટલા અને નવા સંશ્લેષિત કોલેસ્ટ્રોલના 75% સુધી યોગદાન આપી શકે છે (એન્ડેમેન એટ અલ., 1982; ગીલેન એટ અલ., 1983; ફ્રીડ એટ અલ., 1988). કારણ કે AcAc અપૂર્ણ યકૃત ચરબીના ઓક્સિડેશનમાંથી ઉતરી આવ્યું છે, Vivoમાં લિપોજેનેસિસમાં યોગદાન આપવાની AcAc ની ક્ષમતા યકૃતની નિરર્થક સાયકલિંગને સૂચિત કરશે, જ્યાં ચરબીથી મેળવેલા કીટોન્સનો લિપિડ ઉત્પાદન માટે ઉપયોગ કરી શકાય છે, એવી ધારણા કે જેના શારીરિક મહત્વને પ્રાયોગિક માન્યતાની જરૂર છે, પરંતુ તે સાબિત કરી શકે છે. અનુકૂલનશીલ અથવા ખરાબ ભૂમિકાઓ (સોલિનાસ એટ અલ., 2015). AcAc ઉત્સુકપણે કોલેસ્ટેરોજેનેસિસ સપ્લાય કરે છે, ઓછા AACS Km-AcAc (~50 �M) સાથે ફેડ સ્ટેટમાં પણ AcAc સક્રિયકરણની તરફેણ કરે છે (બર્ગસ્ટ્રોમ એટ અલ., 1984). સાયટોપ્લાઝમિક કીટોન ચયાપચયની ગતિશીલ ભૂમિકા પ્રાથમિક માઉસ એમ્બ્રીયોનિક ચેતાકોષોમાં અને 3T3-L1 વ્યુત્પન્ન-એડીપોસાઇટ્સમાં સૂચવવામાં આવી છે, કારણ કે AACS નોકડાઉન દરેક કોષના પ્રકારનું ક્ષતિગ્રસ્ત ભિન્નતા (હસેગાવા એટ અલ., 2012a; હસેગાવા એટ અલ., 2012). વિવોમાં ઉંદરમાં AACS ના નોકડાઉનથી સીરમ કોલેસ્ટ્રોલ ઘટ્યું (હસેગાવા એટ અલ., 2012c). SREBP-2, કોલેસ્ટ્રોલ બાયોસિન્થેસિસનું મુખ્ય ટ્રાન્સક્રિપ્શનલ રેગ્યુલેટર અને પેરોક્સિસોમ પ્રોલિફેરેટર એક્ટિવેટેડ રીસેપ્ટર (PPAR)-? એએસીએસ ટ્રાન્સક્રિપ્શનલ એક્ટિવેટર્સ છે, અને ન્યુરાઇટ ડેવલપમેન્ટ દરમિયાન અને યકૃતમાં તેના ટ્રાન્સક્રિપ્શનને નિયંત્રિત કરે છે (એગ્યુલો એટ અલ., 2010; હસેગાવા એટ અલ., 2012સી). એકસાથે લેવામાં આવે તો, સાયટોપ્લાઝમિક કેટોન બોડી મેટાબોલિઝમ પસંદગીની પરિસ્થિતિઓમાં અથવા રોગના કુદરતી ઇતિહાસમાં મહત્વપૂર્ણ હોઈ શકે છે, પરંતુ તે યકૃતમાંથી મેળવેલા કીટોન શરીરના નિકાલ માટે અપૂરતું છે, કારણ કે કાર્ય પરિવર્તનના નુકશાન દ્વારા પ્રાથમિક ઓક્સિડેટીવ ભાગ્યની પસંદગીયુક્ત ક્ષતિના સેટિંગમાં મોટા પ્રમાણમાં હાયપરકેટોનિમિયા થાય છે. SCOT માટે (બેરી એટ અલ., 2001; કોટર એટ અલ., 2011).
HMGCS2 અને SCOT/OXCT1નું નિયમન
જનીન એન્કોડિંગ સાયટોસોલિક એચએમજીસીએસમાંથી મિટોકોન્ડ્રીયલનું વિચલન કરોડરજ્જુના ઉત્ક્રાંતિની શરૂઆતમાં ઉચ્ચ મગજથી શરીરના વજનના ગુણોત્તર ધરાવતી જાતિઓમાં હેપેટિક કેટોજેનેસિસને સમર્થન આપવાની જરૂરિયાતને કારણે થયું હતું (બુકાફ્ટેન એટ અલ., 1994; કુન્નેન અને ક્રોફોર્ડ, 2003). માનવોમાં કુદરતી રીતે બનતું કાર્ય-ક્ષમતા HMGCS2 પરિવર્તનો હાયપોકેટોટિક હાઈપોગ્લાયકેમિઆના હુમલાઓનું કારણ બને છે (પિટ એટ અલ., 2015; થોમ્પસન એટ અલ., 1997). મજબૂત HMGCS2 અભિવ્યક્તિ હેપેટોસાઇટ્સ અને કોલોનિક એપિથેલિયમ સુધી મર્યાદિત છે, અને તેની અભિવ્યક્તિ અને એન્ઝાઇમેટિક પ્રવૃત્તિ વિવિધ પદ્ધતિઓ દ્વારા સમન્વયિત છે (મસ્કરો એટ અલ., 1995; મેકગેરી અને ફોસ્ટર, 1980; રોબિન્સન અને વિલિયમસન, 1980). જ્યારે HMGCS2 ને પ્રભાવિત કરતા શારીરિક રાજ્યોના સંપૂર્ણ અવકાશને વધુ સ્પષ્ટતાની જરૂર છે, તેની અભિવ્યક્તિ અને/અથવા પ્રવૃત્તિ પ્રારંભિક જન્મ પછીના સમયગાળા દરમિયાન, વૃદ્ધત્વ, ડાયાબિટીસ, ભૂખમરો અથવા કેટોજેનિક આહારનું સેવન (બાલાસે અને ફેરી, 1989; કાહિલ જીએફ જુનિયર, 2006) દરમિયાન નિયંત્રિત થાય છે. ; ગિરાર્ડ એટ અલ., 1992; હેગાર્ડ, 1999; સતાપતિ એટ અલ., 2012; સેનગુપ્તા એટ અલ., 2010). ગર્ભમાં, Hmgcs5 જનીનના 2� ફ્લૅન્કિંગ પ્રદેશનું મેથિલેશન તેના ટ્રાન્સક્રિપ્શન સાથે વિપરીત રીતે સંબંધ ધરાવે છે, અને જન્મ પછી આંશિક રીતે વિપરીત થાય છે (એરિયાસ એટ અલ., 1995; એયટે એટ અલ., 1993; એહારા એટ અલ., 2015; ફેરે એટ અલ. ., 1983). એ જ રીતે, હિપેટિક Bdh1 વિકાસલક્ષી અભિવ્યક્તિની પેટર્ન દર્શાવે છે, જન્મથી દૂધ છોડાવવા સુધી વધે છે, અને ફાઇબ્રોબ્લાસ્ટ વૃદ્ધિ પરિબળ (FGF)-21-આશ્રિત રીતે કેટોજેનિક આહાર દ્વારા પણ પ્રેરિત થાય છે (બેડમેન એટ અલ., 2007; ઝાંગ એટ અલ., 1989) ). સસ્તન પ્રાણીઓમાં કેટોજેનેસિસ ઇન્સ્યુલિન અને ગ્લુકોગન બંને માટે અત્યંત પ્રતિભાવશીલ છે, અનુક્રમે દબાવવામાં આવે છે અને ઉત્તેજિત થાય છે (મેકગેરી અને ફોસ્ટર, 1977). ઇન્સ્યુલિન એડિપોઝ ટીશ્યુ લિપોલીસીસને દબાવી દે છે, આમ તેના સબસ્ટ્રેટના કેટોજેનેસિસને વંચિત કરે છે, જ્યારે ગ્લુકોગન યકૃત પર સીધી અસર દ્વારા કેટોજેનિક પ્રવાહમાં વધારો કરે છે (હેગાર્ડ, 1999). Hmgcs2 ટ્રાન્સક્રિપ્શન ફોર્કહેડ ટ્રાન્સક્રિપ્શનલ ફેક્ટર FOXA2 દ્વારા ઉત્તેજિત થાય છે, જે ઇન્સ્યુલિન-ફોસ્ફેટિડિલિનોસિટોલ-3-કિનાઝ/એક્ટ દ્વારા અટકાવવામાં આવે છે, અને તે ગ્લુકોગન-સીએએમપી-પી300 સિગ્નલિંગ દ્વારા પ્રેરિત છે (એરિયાસ એટ અલ., 1995; 1999; , 1990; થુમેલિન એટ અલ., 1993; વોન મેયેન એટ અલ., 2013; વોલ્ફ્રમ એટ અલ., 2004; વોલ્ફ્રમ એટ અલ., 2003). PPAR? (રોડ્રિગ્ઝ એટ અલ., 1994) તેના લક્ષ્ય સાથે, FGF21 (બેડમેન એટ અલ., 2007) પણ ભૂખમરો અથવા કેટોજેનિક આહારના વહીવટ દરમિયાન યકૃતમાં Hmgcs2 ટ્રાન્સક્રિપ્શન પ્રેરિત કરે છે (બેડમેન એટ અલ., 2007; ઇનાગાકી એટ અલ., 2007 ). PPAR નું ઇન્ડક્શન? ગર્ભમાંથી નિયોનેટલ ફિઝિયોલોજીમાં સંક્રમણ પહેલા થઈ શકે છે, જ્યારે FGF21 સક્રિયકરણ પ્રારંભિક નવજાત સમયગાળામાં હિસ્ટોન ડીસેટીલેઝ (HDAC)-3 (Rando et al., 2016) દ્વારા ?OHB-મધ્યસ્થી નિષેધ દ્વારા તરફેણ કરી શકાય છે. mTORC1 (રેપામિસિન કોમ્પ્લેક્સનું સસ્તન લક્ષ્ય 1) PPAR ના આશ્રિત અવરોધ? ટ્રાન્સક્રિપ્શનલ પ્રવૃત્તિ એ Hmgcs2 જનીન અભિવ્યક્તિ (સેનગુપ્તા એટ અલ., 2010) નું મુખ્ય નિયમનકાર પણ છે અને લીવર PER2, એક માસ્ટર સર્કેડિયન ઓસિલેટર, પરોક્ષ રીતે Hmgcs2 અભિવ્યક્તિનું નિયમન કરે છે (ચવ્હાણ એટ અલ., 2016). તાજેતરના અવલોકનો સૂચવે છે કે એક્સ્ટ્રાહેપેટિક ટ્યુમર-પ્રેરિત ઇન્ટરલ્યુકિન -6 PPAR દ્વારા કેટોજેનેસિસને નબળી પાડે છે? દમન (Flint et al., 2016).
HMGCS2 એન્ઝાઇમ પ્રવૃત્તિ બહુવિધ પેટીએમ દ્વારા નિયંત્રિત થાય છે. HMGCS2 સેરીન ફોસ્ફોરીલેશન વિટ્રોમાં તેની પ્રવૃત્તિમાં વધારો કરે છે (ગ્રિમસ્રુડ એટ અલ., 2012). એચએમજીસીએસ 2 પ્રવૃત્તિ એલોસ્ટેરીલી સક્સીનિલ-કોએ અને લાયસિન રેસિડ્યુ સક્સીનિલેશન દ્વારા અવરોધિત છે (એરિયાસ એટ અલ., 1995; હેગાર્ડ, 1999; લોવે અને ટબ્સ, 1985; ક્વોન્ટ એટ અલ., 1990; રાર્ડિન એટ અલ., 2013. 1975; થુમેલિન એટ અલ., 1993). હેપેટિક મિટોકોન્ડ્રિયામાં HMGCS2, HMGCL, અને BDH1 લાયસિન અવશેષોનું સક્સીનિલેશન એ NAD+ આશ્રિત ડીસીલેઝ સિર્ટુઈન 5 (SIRT5) (Rardin et al., 2013) નું લક્ષ્ય છે. HMGCS2 પ્રવૃત્તિને SIRT3 lysine deacetylation દ્વારા પણ ઉન્નત કરવામાં આવે છે, અને શક્ય છે કે acetylation અને succinylation વચ્ચેનો ક્રોસસ્ટૉક HMGCS2 પ્રવૃત્તિને નિયંત્રિત કરે છે (Rardin et al., 2013; Shimazu et al., 2013). HMGCS2 Km અને Vmax નું નિયમન કરવાની આ પેટીએમની ક્ષમતા હોવા છતાં, આ પેટીએમની વધઘટ હજુ સુધી કાળજીપૂર્વક મેપ કરવામાં આવી નથી અને વિવોમાં કેટોજેનેસિસના મિકેનિસ્ટિક ડ્રાઈવરો તરીકે પુષ્ટિ થઈ નથી.
SCOT હિપેટોસાઇટ્સ સિવાયના તમામ સસ્તન પ્રાણીઓના કોષોમાં વ્યક્ત થાય છે જે મિટોકોન્ડ્રિયાને આશ્રય આપે છે. SCOT પ્રવૃત્તિ અને કીટોલીસીસનું મહત્વ SCOT-KO ઉંદરમાં દર્શાવવામાં આવ્યું હતું, જે જન્મ પછી 48 કલાકની અંદર હાયપરકેટોનેમિક હાઈપોગ્લાયકેમિઆને કારણે સમાન ઘાતકતા દર્શાવે છે (કોટર એટ અલ., 2011). ચેતાકોષો અથવા હાડપિંજરના માયોસાઇટ્સમાં SCOT નું ટીશ્યુ-વિશિષ્ટ નુકશાન ભૂખમરો દરમિયાન મેટાબોલિક અસાધારણતાને પ્રેરિત કરે છે પરંતુ તે ઘાતક નથી (કોટર એટ અલ., 2013b). મનુષ્યોમાં, SCOT ની ઉણપ જીવનની શરૂઆતમાં ગંભીર કેટોએસિડોસિસ સાથે રજૂ કરે છે, જેના કારણે સુસ્તી, ઉલ્ટી અને કોમા થાય છે (બેરી એટ અલ., 2001; ફુકાઓ એટ અલ., 2000; કાસોવસ્કા-બ્રેટિનોવા એટ અલ., 1996; નિઝેન-કોનીંગ એટ અલ. , 1997; સૌદુબ્રે એટ અલ., 1987; સ્નાઇડરમેન એટ અલ., 1998; ટિલ્ડન અને કોર્નબ્લાથ, 1972). SCOT જનીન અને પ્રોટીન અભિવ્યક્તિ નિયમનકારો વિશે સેલ્યુલર સ્તરે પ્રમાણમાં ઓછું જાણીતું છે. Oxct1 mRNA અભિવ્યક્તિ અને SCOT પ્રોટીન અને પ્રવૃત્તિ કેટોટિક રાજ્યોમાં ઘટી રહી છે, સંભવતઃ PPAR-આશ્રિત પદ્ધતિઓ દ્વારા (ફેન્સેલાઉ અને વાલિસ, 1974; ફેન્સેલાઉ અને વાલિસ, 1976; ગ્રિનબ્લેટ એટ અલ., 1986; ઓકુડા એટ અલ., 1991 તુર્કોટ અલ. ., 2001; વેન્ટ્ઝ એટ અલ., 2010). ડાયાબિટીક કેટોએસિડોસિસમાં, હેપેટિક કેટોજેનેસિસ અને એક્સ્ટ્રાહેપેટિક ઓક્સિડેશન વચ્ચેનો મેળ SCOT પ્રવૃત્તિની ક્ષતિને કારણે વધુ તીવ્ર બને છે. કાર્ડિયોમાયોસાઇટ્સમાં ઇન્સ્યુલિન-સ્વતંત્ર ગ્લુકોઝ ટ્રાન્સપોર્ટર (GLUT1/SLC2A1) ની વધુ પડતી અભિવ્યક્તિ પણ Oxct1 જનીન અભિવ્યક્તિને અટકાવે છે અને બિન-કેટોટિક સ્થિતિમાં કેટોન્સના ટર્મિનલ ઓક્સિડેશનને નિયંત્રિત કરે છે (યાન એટ અલ., 2009). યકૃતમાં, Oxct1 mRNA વિપુલતા માઇક્રોઆરએનએ-122 અને હિસ્ટોન મેથિલેશન H3K27me3 દ્વારા દબાવવામાં આવે છે જે ગર્ભથી નવજાત સમયગાળામાં સંક્રમણ દરમિયાન સ્પષ્ટ થાય છે (થોરેઝ એટ અલ., 2011). જો કે, પ્રસૂતિ પછીના સમયગાળામાં હેપેટિક Oxct1 અભિવ્યક્તિનું દમન મુખ્યત્વે યકૃતમાંથી Oxct1- વ્યક્ત કરતા હેમેટોપોએટીક પૂર્વજને ખાલી કરવા માટે જવાબદાર છે, ટર્મિનલી ભિન્ન હિપેટોસાયટ્સમાં અગાઉની Oxct1 અભિવ્યક્તિની ખોટને બદલે. હકીકતમાં, વિભિન્ન હિપેટોસાઇટ્સમાં Oxct1 mRNA અને SCOT પ્રોટીનની અભિવ્યક્તિ અત્યંત ઓછી છે (Orii et al., 2008).
SCOT પણ પેટીએમ દ્વારા નિયંત્રિત થાય છે. એન્ઝાઇમ SIRT3 KO ઉંદરના મગજમાં હાઇપર-એસિટિલેટેડ છે, જે ઘટતા AcAc આધારિત એસિટિલ-CoA ઉત્પાદનને પણ પ્રદર્શિત કરે છે (Dittenhafer-Reed et al., 2015). SCOT ના ટાયરોસિન અવશેષોનું બિન-એન્ઝાઈમેટિક નાઈટ્રેશન પણ તેની પ્રવૃત્તિમાં ઘટાડો કરે છે, જે વિવિધ ડાયાબિટીક ઉંદર મોડલના હૃદયમાં નોંધવામાં આવી છે (માર્કોન્ડેસ એટ અલ., 2001; તુર્કો એટ અલ., 2001; વાંગ એટ અલ., 2010a). તેનાથી વિપરિત, ટ્રિપ્ટોફન અવશેષો નાઈટ્રેશન SCOT પ્રવૃત્તિને વધારે છે (બ્રેગ્રે એટ અલ., 2010; રેબ્રિન એટ અલ., 2007). SCOT પ્રવૃત્તિને મોડ્યુલેટ કરવા માટે રચાયેલ અવશેષ-વિશિષ્ટ નાઈટ્રેશન અથવા ડી-નાઈટ્રેશનની મોલેક્યુલર મિકેનિઝમ્સ અસ્તિત્વમાં હોઈ શકે છે અને તેને સ્પષ્ટીકરણની જરૂર છે.
એક્સ્ટ્રાહેપેટિક કેટોજેનેસિસમાં વિવાદો
સસ્તન પ્રાણીઓમાં પ્રાથમિક કીટોજેનિક અંગ યકૃત છે, અને માત્ર હેપેટોસાયટ્સ અને આંતરડાના ઉપકલા કોષો HMGCS2 (કોટર એટ અલ., 2013a; કોટર એટ અલ., 2014; મેકગેરી અને ફોસ્ટર, 1980 અને વિલિયમસન, 1980; રોબિન, 1995) ના મિટોકોન્ડ્રીયલ આઇસોફોર્મને વિપુલ પ્રમાણમાં વ્યક્ત કરે છે. . જટિલ પોલિસેકરાઇડ્સના એનારોબિક બેક્ટેરિયલ આથોથી બ્યુટારેટ મળે છે, જે ટર્મિનલ ઓક્સિડેશન અથવા કેટોજેનેસિસ (ચેર્બુય એટ અલ., 2016) માટે સસ્તન પ્રાણીઓમાં કોલોનોસાઇટ્સ દ્વારા શોષાય છે, જે કોલોનોસાઇટ ડિફરન્સિએશનમાં ભૂમિકા ભજવી શકે છે (વાંગ એટ અલ. 2, 2014). આંતરડાના ઉપકલા કોષો અને હેપેટોસાયટ્સને બાદ કરતાં, HMGCS1992 લગભગ અન્ય તમામ સસ્તન કોષોમાં લગભગ ગેરહાજર છે, પરંતુ ગાંઠ કોષો, સેન્ટ્રલ નર્વસ સિસ્ટમના એસ્ટ્રોસાઇટ્સ, કિડની, સ્વાદુપિંડમાં એક્સ્ટ્રાહેપેટિક કેટોજેનેસિસની સંભાવના ઊભી થઈ છે? કોષો, રેટિના પિગમેન્ટ એપિથેલિયમ (RPE), અને હાડપિંજરના સ્નાયુઓમાં પણ (એડિજાન્ટો એટ અલ., 2016; એવોગારો એટ અલ., 2016; અલ એઝોની એટ અલ., 2015; ગ્રેબકા એટ અલ., 2014; કાંગ એટ અલ., 2016 ; Le Foll et al., 2016; Nonaka et al., 2016; Takagi et al., 2011a; Thevenet et al., 2; Zhang et al., 2016). એક્ટોપિક HMGCS2010 નેટ કેટોજેનિક ક્ષમતાનો અભાવ ધરાવતા પેશીઓમાં જોવામાં આવ્યું છે (કુક એટ અલ., 2; વેન્ટ્ઝ એટ અલ., 2016), અને HMGCS2010 સંભવિત કેટોજેનેસિસ-સ્વતંત્ર મૂનલાઇટિંગ પ્રવૃત્તિઓ દર્શાવે છે, જેમાં સેલ ન્યુક્લિયસ (ચેન એટ અલ. , 1998; કોસ્ટીયુક એટ અલ., XNUMX; મીરટેન્સ એટ અલ., XNUMX).
કોઈપણ એક્સ્ટ્રાહેપેટિક પેશી કે જે કેટોન બોડીને ઓક્સિડાઇઝ કરે છે તેમાં પણ HMGCS2 સ્વતંત્ર મિકેનિઝમ્સ (ફિગ. 2A) દ્વારા કેટોન બોડી એકઠા કરવાની ક્ષમતા હોય છે. જો કે, ત્યાં કોઈ એક્સ્ટ્રાહેપેટિક પેશી નથી કે જેમાં સ્થિર સ્ટેટ કેટોન બોડીની સાંદ્રતા પરિભ્રમણમાં (કોટર એટ અલ., 2011; કોટર એટ અલ., 2013b; હેરિસન અને લોંગ, 1940) કરતાં વધી જાય, જે નીચે દર્શાવેલ છે કે કેટોન બોડીને નીચે વહન કરવામાં આવે છે. MCT1/2-આશ્રિત પદ્ધતિઓ દ્વારા એકાગ્રતા ઢાળ. દેખીતી એક્સ્ટ્રાહેપેટિક કેટોજેનેસિસની એક પદ્ધતિ ખરેખર કેટોન ઓક્સિડેશનની સંબંધિત ક્ષતિને પ્રતિબિંબિત કરી શકે છે. વધારાના સંભવિત ખુલાસાઓ કેટોન બોડી રચનાના ક્ષેત્રમાં આવે છે. પ્રથમ, ડી નોવો કેટોજેનેસિસ થિયોલેઝ અને SCOT (વેઇડમેન અને ક્રેબ્સ, 1969) ની ઉલટાવી શકાય તેવી એન્ઝાઇમેટિક પ્રવૃત્તિ દ્વારા થઈ શકે છે. જ્યારે એસિટિલ-કોએની સાંદ્રતા પ્રમાણમાં ઊંચી હોય છે, ત્યારે સામાન્ય રીતે AcAc ઓક્સિડેશન માટે જવાબદાર પ્રતિક્રિયાઓ વિપરીત દિશામાં કાર્ય કરે છે (ગોલ્ડમેન, 1954). બીજી પદ્ધતિ ત્યારે થાય છે જ્યારે ?-ઓક્સિડેશન-પ્રાપ્ત મધ્યવર્તી ટીસીએ ચક્ર અવરોધને કારણે એકઠા થાય છે, AcAc-CoA એ મિટોકોન્ડ્રીયલ 3-hydroxyacyl-CoA ડિહાઈડ્રોજેનેઝ દ્વારા ઉત્પ્રેરિત પ્રતિક્રિયા દ્વારા l-?OHB-CoA માં રૂપાંતરિત થાય છે, અને આગળ 3-હાઈડ્રોક્સીબ્યુએટ CoA deacylase to l-?OHB, જે ફિઝિયોલોજિકલ enantiomer d-?OHB (રીડ અને ઓઝાંડ, 1980) થી માસ સ્પેક્ટ્રોમેટ્રી અથવા રેઝોનન્સ સ્પેક્ટ્રોસ્કોપી દ્વારા અસ્પષ્ટ છે. l-?OHB ને chromatographically અથવા enzymatically d-?OHB થી અલગ કરી શકાય છે, અને તે એક્સ્ટ્રાહેપેટિક પેશીઓમાં હાજર છે, પરંતુ યકૃત અથવા લોહીમાં નથી (Hsu et al., 2011). હેપેટિક કેટોજેનેસિસ માત્ર d-?OHB ઉત્પન્ન કરે છે, જે એક માત્ર BDH સબસ્ટ્રેટ છે (Ito et al., 1984; Lincoln et al., 1987; Reed and Ozand, 1980; Scofield et al., 1982; Scofield et al. 1982). ત્રીજું HMGCS2-સ્વતંત્ર મિકેનિઝમ એમિનો એસિડ કેટાબોલિઝમ, ખાસ કરીને લ્યુસીન અને લાયસિન દ્વારા d-?OHB પેદા કરે છે. ચોથી મિકેનિઝમ માત્ર સ્પષ્ટ છે કારણ કે તે લેબલિંગ આર્ટિફેક્ટને કારણે છે અને તેથી તેને સ્યુડોકેટોજેનેસિસ કહેવામાં આવે છે. આ ઘટના SCOT અને થિઓલેઝ પ્રતિક્રિયાઓની ઉલટાવી શકાય તે માટે આભારી છે, અને એક્સ્ટ્રાહેપેટિક પેશીઓમાં કેટોન બોડી ટ્રેસરના આઇસોટોપિક મંદીને કારણે કેટોન બોડી ટર્નઓવરને વધુ પડતો અંદાજ આપી શકે છે (ડેસ રોઝિયર્સ એટ અલ., 1990; ફિંક એટ અલ., 1988) . તેમ છતાં, મોટાભાગના સંદર્ભોમાં સ્યુડોકેટોજેનેસિસ નગણ્ય હોઈ શકે છે (બેઈલી એટ અલ., 1990; કેલર એટ અલ., 1978). એક યોજનાકીય (ફિગ. 2A) કીટોન્સની એલિવેટેડ ટીશ્યુ સ્ટેડી સ્ટેટ સાંદ્રતાને ધ્યાનમાં રાખીને લાગુ કરવા માટે ઉપયોગી અભિગમ સૂચવે છે.
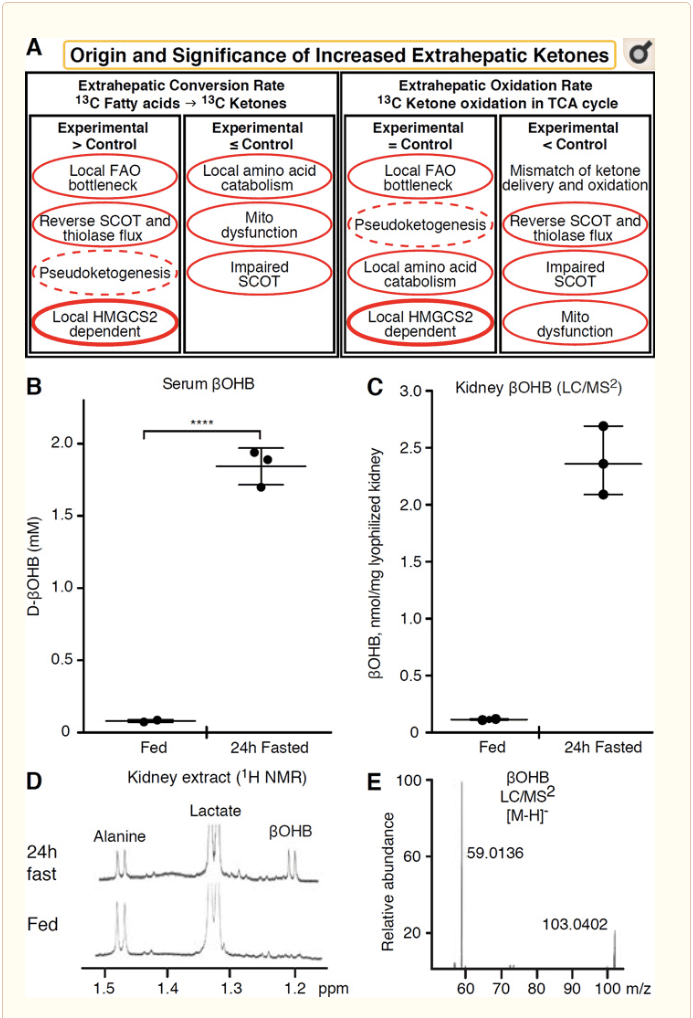

કિડનીએ તાજેતરમાં સંભવિત કેટોજેનિક અંગ તરીકે ધ્યાન મેળવ્યું છે. મોટા ભાગના રાજ્યોમાં, કિડની એ લીવરમાંથી મેળવેલા કીટોન બોડીનો ચોખ્ખો ઉપભોક્તા છે, જે લોહીના પ્રવાહમાંથી કેટોન બોડીને ઉત્સર્જન કરે છે અથવા ફરીથી શોષી લે છે, અને કિડની સામાન્ય રીતે ચોખ્ખી કીટોન બોડી જનરેટર અથવા કોન્સેન્ટ્રેટર નથી (રોબિન્સન અને વિલિયમસન, 1980). શાસ્ત્રીય અભ્યાસના લેખકોએ તારણ કાઢ્યું હતું કે કૃત્રિમ પ્રાયોગિક પ્રણાલીમાં ન્યૂનતમ રેનલ કેટોજેનેસિસનું પ્રમાણ શારીરિક રીતે સંબંધિત નથી (વેઇડમેન અને ક્રેબ્સ, 1969). તાજેતરમાં, ડાયાબિટીક અને ઓટોફેજીની ઉણપ ધરાવતા માઉસ મોડલ્સમાં રેનલ કેટોજેનેસિસનું અનુમાન કરવામાં આવ્યું છે, પરંતુ મેટાબોલિક હોમિયોસ્ટેસિસમાં બહુ-અંગો પરિવર્તન બહુવિધ અવયવો પરના ઇનપુટ્સ દ્વારા સંકલિત કેટોન ચયાપચયમાં ફેરફાર કરે તેવી શક્યતા વધુ છે (તાકાગી એટ અલ., 2016a; ટાકાગી. અલ. 2016b; ઝાંગ એટ અલ., 2011). તાજેતરના એક પ્રકાશનમાં કિડનીમાં ઇસ્કેમિયા-રિપરફ્યુઝન ઇજા સામે રક્ષણાત્મક પદ્ધતિ તરીકે રેનલ કેટોજેનેસિસ સૂચવવામાં આવ્યું છે (ટ્રાન એટ અલ., 2016). ઉંદર રેનલ ટિશ્યુના અર્કમાંથી ?OHB ની સંપૂર્ણ સ્થિર રાજ્ય સાંદ્રતા ~4�12 એમએમ પર નોંધવામાં આવી હતી. આ યોગ્ય છે કે કેમ તે ચકાસવા માટે, અમે ખવડાવેલા અને 24 કલાક ઉપવાસ કરેલા ઉંદરમાંથી રેનલ અર્કમાં OHB સાંદ્રતાનું પ્રમાણ નક્કી કર્યું. સીરમ ? 100 કલાકના ઉપવાસ સાથે OHB સાંદ્રતા ~2 �M થી વધીને 24 mM થઈ ગઈ છે, જ્યારે મૂત્રપિંડ સ્થિર અવસ્થામાં ? OHB સાંદ્રતા 2 કલાકના ઉપવાસની સ્થિતિમાં અંદાજે 100 �M છે, અને 1 કલાકના ઉપવાસની સ્થિતિમાં માત્ર 24 mM (ફિગ. 2C�E), અવલોકનો કે જે 45 વર્ષ પહેલાં માપવામાં આવેલી સાંદ્રતા સાથે સુસંગત છે (હેમ્સ અને બ્રોસ્નાન, 1970). તે શક્ય છે કે કેટોટિક રાજ્યોમાં, યકૃતમાંથી મેળવેલા કીટોન શરીર રિનોપ્રોટેક્ટીવ હોઈ શકે છે, પરંતુ રેનલ કેટોજેનેસિસના પુરાવા માટે વધુ પુરાવાની જરૂર છે. સાચા એક્સ્ટ્રાહેપેટિક કેટોજેનેસિસને સમર્થન આપતા આકર્ષક પુરાવા RPE (Adijanto et al., 2014) માં રજૂ કરવામાં આવ્યા હતા. આ રસપ્રદ મેટાબોલિક રૂપાંતરણને RPE-પ્રાપ્ત કીટોન્સને ફોટોરિસેપ્ટર અથવા મુલર ગ્લિયા કોષોમાં વહેવા દેવા માટે સૂચવવામાં આવ્યું હતું, જે ફોટોરિસેપ્ટર બાહ્ય સેગમેન્ટના પુનર્જીવનમાં મદદ કરી શકે છે.
એક સિગ્નલિંગ મધ્યસ્થી તરીકે OHB
જો કે તેઓ ઉર્જાથી સમૃદ્ધ છે, કેટોન બોડી સેલ્યુલર હોમિયોસ્ટેસિસ (ફિગ. 3) (ન્યૂમેન અને વર્ડિન, 2014; રોજાસ-મોરાલેસ એટ અલ., 2016) માં ઉત્તેજક ‘નોન-પ્રમાણિક’ સિગ્નલિંગ ભૂમિકા ભજવે છે. ઉદાહરણ તરીકે, ?OHB વર્ગ I HDAC ને અટકાવે છે, જે હિસ્ટોન એસિટિલેશનને વધારે છે અને ત્યાંથી જનીનોની અભિવ્યક્તિને પ્રેરિત કરે છે જે ઓક્સિડેટીવ તણાવને ઘટાડે છે (શિમાઝુ એટ અલ., 2013). ?OHB પોતે ફાસ્ટેડ અથવા સ્ટ્રેપ્ટોઝોટોસિન પ્રેરિત ડાયાબિટીક ઉંદર (Xie એટ અલ., 2016) ના યકૃતમાં લાયસિન અવશેષો પર હિસ્ટોન સહસંયોજક સંશોધક છે (નીચે પણ જુઓ, કેટોન બોડી મેટાબોલિઝમ, પોસ્ટ-ટ્રાન્સલેશનલ મોડિફિકેશન, અને સેલ ફિઝિયોલોજીનું એકીકરણ. કેટોન બોડીઝ, ઓક્સિડેટીવ સ્ટ્રેસ અને ન્યુરોપ્રોટેક્શન).
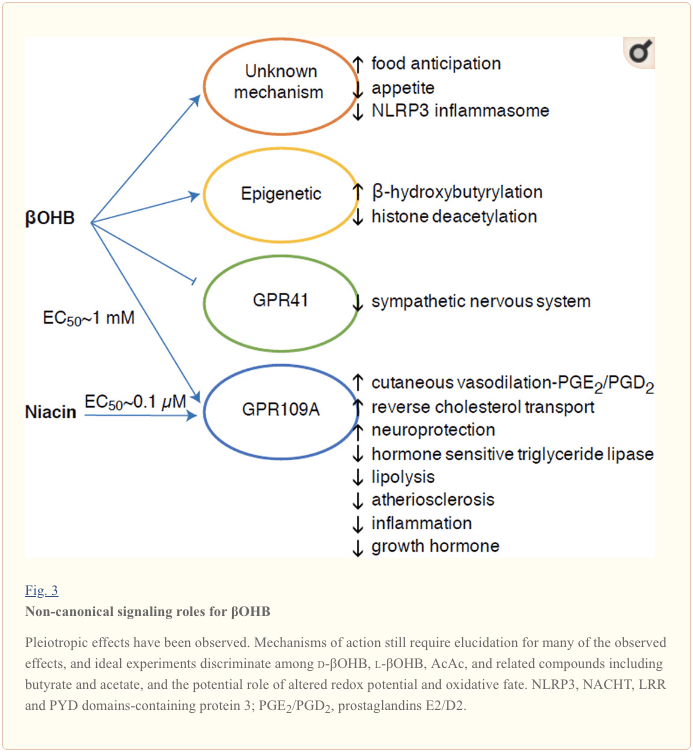
OHB એ જી-પ્રોટીન કમ્પલ્ડ રીસેપ્ટર્સ દ્વારા પણ અસરકર્તા છે. અસ્પષ્ટ મોલેક્યુલર મિકેનિઝમ્સ દ્વારા, તે સહાનુભૂતિશીલ નર્વસ સિસ્ટમની પ્રવૃત્તિને દબાવી દે છે અને જી પ્રોટીન કમ્પલ્ડ રીસેપ્ટર 41 (GPR41) (કિમુરા એટ અલ., 2011) દ્વારા શોર્ટ ચેઇન ફેટી એસિડ સિગ્નલિંગને અટકાવીને કુલ ઊર્જા ખર્ચ અને હૃદયના ધબકારા ઘટાડે છે. ?OHB ની સૌથી વધુ અભ્યાસ કરાયેલ સિગ્નલિંગ અસરોમાંની એક GPR109A (HCAR2 તરીકે પણ ઓળખાય છે) દ્વારા આગળ વધે છે, હાઇડ્રોકાર્બોક્સિલિક એસિડ GPCR પેટા-કુટુંબના સભ્ય જે એડિપોઝ પેશીઓ (સફેદ અને ભૂરા) માં વ્યક્ત થાય છે (તુનારુ એટ અલ., 2003), અને તેમાં રોગપ્રતિકારક કોષો (અહમદ એટ અલ., 2009). ?OHB એ GPR109A રીસેપ્ટર (EC50 ~770 �M) નું એકમાત્ર જાણીતું અંતર્જાત લિગાન્ડ છે જે d-?OHB, l-?OHB, અને બ્યુટીરેટ દ્વારા સક્રિય થયેલ છે, પરંતુ AcAc (ટેગાર્ટ એટ અલ., 2005) દ્વારા સક્રિય નથી. GPR109A સક્રિયકરણ માટે ઉચ્ચ સાંદ્રતા થ્રેશોલ્ડ કેટોજેનિક આહારના પાલન દ્વારા, ભૂખમરો અથવા કેટોએસિડોસિસ દરમિયાન પ્રાપ્ત થાય છે, જે એડિપોઝ ટીશ્યુ લિપોલીસીસના અવરોધ તરફ દોરી જાય છે. GPR109A ની એન્ટિ-લિપોલિટીક અસર એડેનાઇલ સાયકલેસના અવરોધ અને સીએએમપીમાં ઘટાડો દ્વારા આગળ વધે છે, જે હોર્મોન સંવેદનશીલ ટ્રાઇગ્લિસેરાઇડ લિપેઝને અવરોધે છે (અહમદ એટ અલ., 2009; તુનારુ એટ અલ., 2003). આ નકારાત્મક પ્રતિસાદ લૂપ બનાવે છે જેમાં કેટોસીસ એડિપોસાઇટ્સમાંથી નોન-એસ્ટેરિફાઇડ ફેટી એસિડ્સનું પ્રકાશન ઘટાડીને કેટોજેનેસિસ પર મોડ્યુલેટરી બ્રેક મૂકે છે (અહમદ એટ અલ., 2009; ટેગગાર્ટ એટ અલ., 2005), એક અસર જે પ્રતિસંતુલિત થઈ શકે છે. સહાનુભૂતિશીલ ડ્રાઇવ જે લિપોલીસીસને ઉત્તેજિત કરે છે. નિયાસિન (વિટામિન B3, નિકોટિનિક એસિડ) એ GRP50A માટે એક બળવાન (EC0.1 ~ 109 �M) લિગાન્ડ છે, જે ડિસ્લિપિડેમિયા માટે દાયકાઓથી અસરકારક રીતે કાર્યરત છે (બેન્યો એટ અલ., 2005; બેન્યો એટ અલ., 2006; ફેબ્રિની, એટ અલ., 2010; ફેબ્રિની એટ અલ. લુકાસોવા એટ અલ., 2011; તુનારુ એટ અલ., 2003). જ્યારે નિયાસિન મેક્રોફેજમાં વિપરીત કોલેસ્ટ્રોલ પરિવહનને વધારે છે અને એથરોસ્ક્લેરોટિક જખમ ઘટાડે છે (લુકાસોવા એટ અલ., 2011), એથરોસ્ક્લેરોટિક જખમ પર ?OHB ની અસરો અજાણ છે. જોકે GPR109A રીસેપ્ટર રક્ષણાત્મક ભૂમિકા ભજવે છે, અને સ્ટ્રોક અને ન્યુરોડિજનરેટિવ રોગોમાં કેટોજેનિક આહારના ઉપયોગ વચ્ચે રસપ્રદ જોડાણો અસ્તિત્વમાં છે (ફૂ એટ અલ., 2015; રહેમાન એટ અલ., 2014), GPR109A દ્વારા OHB ની રક્ષણાત્મક ભૂમિકા vivo માં દર્શાવવામાં આવી નથી. .
છેલ્લે, ?OHB ભૂખ અને તૃપ્તિને પ્રભાવિત કરી શકે છે. અભ્યાસોના મેટા-વિશ્લેષણ કે જે કેટોજેનિક અને ખૂબ ઓછી ઉર્જા આહારની અસરોને માપે છે તે નિષ્કર્ષ પર આવ્યું છે કે આ આહાર લેનારા સહભાગીઓ નિયંત્રણ આહારની તુલનામાં ઉચ્ચ તૃપ્તિ દર્શાવે છે (ગિબ્સન એટ અલ., 2015). જો કે, આ અસર માટે બુદ્ધિગમ્ય સમજૂતી એ વધારાના મેટાબોલિક અથવા હોર્મોનલ તત્વો છે જે ભૂખમાં ફેરફાર કરી શકે છે. ઉદાહરણ તરીકે, ઉંદરના કેટોજેનિક આહાર પર જાળવવામાં આવતા ઉંદરોએ ચાઉ કંટ્રોલ-ફીડ ઉંદરોની સરખામણીમાં ઉર્જા ખર્ચમાં વધારો દર્શાવ્યો હતો, સમાન કેલરી હોવા છતાં, અને ફરતા લેપ્ટિન અથવા ખોરાકની વર્તણૂકનું નિયમન કરતા પેપ્ટાઇડ્સના જનીનો બદલાયા ન હતા (કેનેડી એટ અલ., 2007). OHB દ્વારા ભૂખ દબાવવાનું સૂચન કરતી સૂચિત પદ્ધતિઓમાં સિગ્નલિંગ અને ઓક્સિડેશન બંનેનો સમાવેશ થાય છે (લેગર એટ અલ., 2010). સર્કેડિયન રિધમ જનીન (Per2) અને ક્રોમેટિન ઇમ્યુનોપ્રિસિપિટેશન અભ્યાસોને હેપેટોસાઇટ ચોક્કસ કાઢી નાખવાથી જાણવા મળ્યું છે કે PER2 સીધા Cpt1a જનીનને સક્રિય કરે છે, અને પરોક્ષ રીતે Hmgcs2 ને નિયમન કરે છે, જે Per2 નોકઆઉટ ઉંદરમાં ક્ષતિગ્રસ્ત કીટોસિસ તરફ દોરી જાય છે (Chavanet2016). આ ઉંદરોએ અશક્ત ખોરાકની અપેક્ષા દર્શાવી હતી, જે આંશિક રીતે પ્રણાલીગત ?OHB વહીવટ દ્વારા પુનઃસ્થાપિત કરવામાં આવી હતી. સેન્ટ્રલ નર્વસ સિસ્ટમને પ્રત્યક્ષ ?OHB લક્ષ્ય તરીકે પુષ્ટિ કરવા માટે ભાવિ અભ્યાસોની જરૂર પડશે, અને શું અવલોકન કરાયેલ અસરો માટે કેટોન ઓક્સિડેશન જરૂરી છે, અથવા અન્ય સિગ્નલિંગ મિકેનિઝમ સામેલ છે કે કેમ. અન્ય તપાસકર્તાઓએ ખોરાકના સેવનના નિયમનકાર તરીકે વેન્ટ્રોમેડિયલ હાયપોથાલેમસની અંદર સ્થાનિક એસ્ટ્રોસાઇટ-પ્રાપ્ત કીટોજેનેસિસની શક્યતાનો ઉપયોગ કર્યો છે, પરંતુ આ પ્રારંભિક અવલોકનો પણ આનુવંશિક અને પ્રવાહ-આધારિત મૂલ્યાંકનોથી લાભ મેળવશે (લે ફોલ એટ અલ., 2014). કીટોસિસ અને પોષક તત્ત્વોની વંચિતતા વચ્ચેનો સંબંધ રસનો રહે છે કારણ કે ભૂખ અને તૃપ્તિ એ વજન ઘટાડવાના નિષ્ફળ પ્રયાસોમાં મહત્વપૂર્ણ ઘટકો છે.
કેટોન બોડી મેટાબોલિઝમ, પોસ્ટ-ટ્રાન્સલેશનલ મોડિફિકેશન અને સેલ ફિઝિયોલોજીનું એકીકરણ
કેટોન બોડી એસિટિલ-કોએના કમ્પાર્ટમેન્ટલાઇઝ્ડ પૂલમાં ફાળો આપે છે, જે એક મુખ્ય મધ્યવર્તી છે જે સેલ્યુલર મેટાબોલિઝમમાં અગ્રણી ભૂમિકાઓ દર્શાવે છે (પીટ્રોકોલા એટ અલ., 2015). એસીટીલ-કોએની એક ભૂમિકા એસીટીલેશન માટે સબસ્ટ્રેટ તરીકે સેવા આપવાની છે, એન્ઝાઈમેટિકલી-ઉત્પ્રેરિત હિસ્ટોન સહસંયોજક ફેરફાર (ચૌધરી એટ અલ., 2014; દત્તા એટ અલ., 2016; ફેન એટ અલ., 2015; મેન્ઝીસ એટ અલ., 2016 ). મોટી સંખ્યામાં ડાયનેમિકલી એસીટીલેટેડ મિટોકોન્ડ્રીયલ પ્રોટીન, જેમાંથી ઘણા નોન-એન્ઝાઈમેટિક મિકેનિઝમ દ્વારા થઈ શકે છે, તે કોમ્પ્યુટેશનલ પ્રોટીઓમિક્સ અભ્યાસોમાંથી પણ ઉભરી આવ્યા છે (ડિટેનહેફર-રીડ એટ અલ., 2015; હેબર્ટ એટ અલ., 2013; રાર્ડિન એટ અલ., 2013 ; શિમાઝુ એટ અલ., 2010). લાયસિન ડીસીટીલેસીસ ઝીંક કોફેક્ટર (દા.ત., ન્યુક્લિયોસાયટોસોલિક HDACs) અથવા NAD+ નો કો-સબસ્ટ્રેટ (સિર્ટુઇન્સ, SIRTs) તરીકે ઉપયોગ કરે છે (ચૌધરી એટ અલ., 2014; મેન્ઝીસ એટ અલ., 2016). એસીટીલપ્રોટીઓમ કુલ સેલ્યુલર એસિટિલ-કોએ પૂલના સેન્સર અને અસરકર્તા બંને તરીકે કામ કરે છે, કારણ કે શારીરિક અને આનુવંશિક મેનીપ્યુલેશન દરેક એસિટિલેશનના બિન-એન્ઝાઈમેટિક વૈશ્વિક ફેરફારોમાં પરિણમે છે (વેઇનર્ટ એટ અલ., 2014). ઇન્ટ્રાસેલ્યુલર મેટાબોલિટ્સ લાયસિન રેસિડ્યુ એસિટિલેશનના મોડ્યુલેટર તરીકે સેવા આપે છે, તે કીટોન બોડીની ભૂમિકાને ધ્યાનમાં લેવી મહત્વપૂર્ણ છે, જેની વિપુલતા અત્યંત ગતિશીલ છે.
?OHB એ ઓછામાં ઓછા બે મિકેનિઝમ્સ દ્વારા એપિજેનેટિક મોડિફાયર છે. ઉપવાસ, કેલરી પ્રતિબંધ, ડાયરેક્ટ એડમિનિસ્ટ્રેશન અથવા લાંબા સમય સુધી કસરત દ્વારા પ્રેરિત OHB સ્તરમાં વધારો HDAC અવરોધ અથવા હિસ્ટોન એસિટિલટ્રાન્સફેરેસ સક્રિયકરણ (મારોસી એટ અલ., 2016; સ્લીમેન એટ અલ., 2016) અથવા ઓક્સિડેટીવ સ્ટ્રેસ (શિમાઝુ,2013) . ?HDAC3 નું OHB નિષેધ નવજાત મેટાબોલિક ફિઝિયોલોજીનું નિયમન કરી શકે છે (Rando et al., 2016). સ્વતંત્ર રીતે, ?OHB પોતે હિસ્ટોન લાયસિન અવશેષોને સીધી રીતે સુધારે છે (Xie et al., 2016). લાંબા સમય સુધી ઉપવાસ, અથવા સ્ટેપટોઝોટોસિન-પ્રેરિત ડાયાબિટીક કીટોએસિડોસિસ હિસ્ટોન?-હાઈડ્રોક્સીબ્યુટીરીલેશનમાં વધારો કરે છે. જો કે લાયસિન?-હાઈડ્રોક્સીબ્યુટીરીલેશન અને એસિટિલેશન સાઇટ્સની સંખ્યા તુલનાત્મક હતી, એસિટિલેશન કરતાં સ્ટોઇકિયોમેટ્રિકલી વધુ હિસ્ટોન?-હાઈડ્રોક્સીબ્યુટીરીલેશન જોવા મળ્યું હતું. વિશિષ્ટ જનીનો પર હિસ્ટોન લાયસિન?-હાઈડ્રોક્સીબ્યુટીરીલેશન, વિરુદ્ધ એસિટિલેશન અથવા મેથાઈલેશન દ્વારા અસર થઈ હતી, જે અલગ સેલ્યુલર કાર્યો સૂચવે છે. શું ?-હાઈડ્રોક્સીબ્યુટીરીલેશન સ્વયંસ્ફુરિત છે કે એન્ઝાઈમેટિક છે તે જાણી શકાયું નથી, પરંતુ કેટોન બોડી દ્વારા મિકેનિઝમ્સની શ્રેણીને ગતિશીલ રીતે ટ્રાન્સક્રિપ્શનને પ્રભાવિત કરે છે.
કેલરી પ્રતિબંધ અને પોષક તત્ત્વોની વંચિતતા દરમિયાન આવશ્યક કોષ પુનઃપ્રોગ્રામિંગની ઘટનાઓ અનુક્રમે SIRT3- અને SIRT5-આશ્રિત મિટોકોન્ડ્રીયલ ડિસીટીલેશન અને ડેસ્યુસીનિલેશનમાં મધ્યસ્થી થઈ શકે છે, જે લીવર અને એક્સ્ટ્રા હેપેટીક, ટાઈટિસ્યુટેન્સ (એસ્ટ્રા હેપેટીક. 2015; હેબર્ટ એટ અલ., 2013; રાર્ડિન એટ અલ., 2013; શિમાઝુ એટ અલ., 2010). ભલે કબજે કરેલી સાઇટ્સની સ્ટોઇકિયોમેટ્રિક સરખામણી મેટાબોલિક ફ્લક્સમાં થતી શિફ્ટ સાથે સીધી રીતે જોડાયેલી હોય તે જરૂરી નથી, મિટોકોન્ડ્રીયલ એસિટિલેશન ગતિશીલ છે અને એન્ઝાઇમેટિક એસિટિલટ્રાન્સફેરેસિસ અને પેયગોનેર (W2013) ને બદલે એસિટિલ-CoA સાંદ્રતા અથવા મિટોકોન્ડ્રીયલ pH દ્વારા સંચાલિત થઈ શકે છે. તે SIRT3 અને SIRT5 કેટોન બોડી મેટાબોલાઇઝિંગ એન્ઝાઇમ્સની પ્રવૃત્તિઓને મોડ્યુલેટ કરે છે, જે એસિટિલપ્રોટીઓમ, સક્સીનિલપ્રોટીઓમ અને અન્ય ગતિશીલ સેલ્યુલર લક્ષ્યોને શિલ્પ બનાવવામાં કેટોન્સની પારસ્પરિક ભૂમિકાના પ્રશ્નને ઉશ્કેરે છે. ખરેખર, કેટોજેનેસિસની વિવિધતાઓ NAD+ સાંદ્રતાને પ્રતિબિંબિત કરે છે, કેટોનનું ઉત્પાદન અને વિપુલતા સિર્ટુઇન પ્રવૃત્તિને નિયંત્રિત કરી શકે છે, જેનાથી કુલ એસિટિલ-CoA/સ્યુસીનિલ-CoA પૂલ, એસિલપ્રોટીઓમ અને આ રીતે મિટોકોન્ડ્રીયલ અને સેલ ફિઝિયોલોજીને પ્રભાવિત કરે છે. ?- એન્ઝાઇમ લાયસિન અવશેષોનું હાઇડ્રોક્સીબ્યુટીરીલેશન સેલ્યુલર રિપ્રોગ્રામિંગમાં અન્ય સ્તર ઉમેરી શકે છે. એક્સ્ટ્રાહેપેટિક પેશીઓમાં, કેટોન બોડી ઓક્સિડેશન સેલ હોમિયોસ્ટેસિસમાં સમાન ફેરફારોને ઉત્તેજિત કરી શકે છે. જ્યારે એસિટિલ-કોએ પૂલનું કમ્પાર્ટમેન્ટેશન અત્યંત નિયમન કરે છે અને સેલ્યુલર ફેરફારોના વ્યાપક સ્પેક્ટ્રમનું સંકલન કરે છે, ત્યારે કેટોન બોડીની મિટોકોન્ડ્રીયલ અને સાયટોપ્લાઝમિક એસિટિલ-CoA સાંદ્રતા બંનેને સીધો આકાર આપવાની ક્ષમતાને સ્પષ્ટીકરણની જરૂર છે (ચેન એટ અલ., 2012; કોર્બેટ, અલ. 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen and Thompson, 2012). કારણ કે એસિટિલ-CoA સાંદ્રતા ચુસ્તપણે નિયમન કરવામાં આવે છે, અને એસિટિલ-CoA એ મેમ્બ્રેન અનિવાર્ય છે, એસીટીલ-CoA હોમિયોસ્ટેસિસનું સંકલન કરતી ડ્રાઇવર મિકેનિઝમ્સને ધ્યાનમાં લેવી નિર્ણાયક છે, જેમાં TCA ચક્રમાં ઉત્પાદન અને ટર્મિનલ ઓક્સિડેશનનો દર, કેટોન બોડીમાં રૂપાંતર, કેટોન બોડીનો સમાવેશ થાય છે. કાર્નેટીન એસિટિલટ્રાન્સફેરેઝ (CrAT) દ્વારા પ્રવાહ અથવા એસીટીલ-CoA સાઇટ્રેટમાં રૂપાંતર પછી સાયટોસોલમાં નિકાસ થાય છે અને ATP સાઇટ્રેટ લાયઝ (ACLY) દ્વારા મુક્ત થાય છે. સેલ એસિટિલપ્રોટીઓમ અને હોમિયોસ્ટેસિસમાં આ પછીની પદ્ધતિઓની મુખ્ય ભૂમિકાઓ માટે કેટોજેનેસિસ અને કેટોન ઓક્સિડેશનની ભૂમિકાઓની મેળ ખાતી સમજની જરૂર છે (દાસ એટ અલ., 2015; મેકડોનેલ એટ અલ., 2016; મૌસેઇફ એટ અલ., 2015; અલ. 2015; Seiler et al., 2014; Seiler et al., 2015; Wellen et al., 2009; Wellen and Thompson, 2012). આનુવંશિક રીતે મેનિપ્યુલેટેડ મોડલના સેટિંગમાં મેટાબોલોમિક્સ અને એસિલપ્રોટીઓમિક્સમાં કન્વર્જન્ટ ટેક્નોલોજીઓને લક્ષ્યો અને પરિણામોનો ઉલ્લેખ કરવાની જરૂર પડશે.
કેટોન બોડીઝ માટે વિરોધી અને પ્રો-ઇન્ફ્લેમેટરી રિસ્પોન્સ
કેટોસિસ અને કેટોન બોડીઝ બળતરા અને રોગપ્રતિકારક કોષના કાર્યને મોડ્યુલેટ કરે છે, પરંતુ વૈવિધ્યસભર અને અસંગત પદ્ધતિઓ પણ પ્રસ્તાવિત કરવામાં આવી છે. લાંબા સમય સુધી પોષક તત્ત્વોની વંચિતતા બળતરા ઘટાડે છે (યોમ એટ અલ., 2015), પરંતુ પ્રકાર 1 ડાયાબિટીસની ક્રોનિક કીટોસિસ એ બળતરા તરફી સ્થિતિ છે (જૈન એટ અલ., 2002; કનિકર્લા-મેરી અને જૈન, 2015; કુરેપા એટ અલ. 2012, 109. ). બળતરામાં ?OHB માટે મિકેનિઝમ-આધારિત સિગ્નલિંગ ભૂમિકાઓ ઉભરી આવે છે કારણ કે મેક્રોફેજ અથવા મોનોસાઇટ્સ સહિત ઘણા રોગપ્રતિકારક તંત્રના કોષો GPR2014Aને વિપુલ પ્રમાણમાં વ્યક્ત કરે છે. જ્યારે ?OHB મુખ્યત્વે બળતરા વિરોધી પ્રતિભાવ આપે છે (ફુ એટ અલ., 2012; ગંભીર એટ અલ., 2014; રહેમાન એટ અલ., 2015; યુમ એટ અલ., 2002), કીટોન બોડીની ઉચ્ચ સાંદ્રતા, ખાસ કરીને AcAc, કદાચ બળતરા તરફી પ્રતિભાવને ટ્રિગર કરે છે (જૈન એટ અલ., 2015; કનિકર્લા-મેરી અને જૈન, 2012; કુરેપા એટ અલ., XNUMX).
એથરોસ્ક્લેરોસિસ, સ્થૂળતા, બળતરા આંતરડા રોગ, ન્યુરોલોજીકલ રોગ અને કેન્સરમાં GPR109A લિગાન્ડ્સની બળતરા વિરોધી ભૂમિકાઓની સમીક્ષા કરવામાં આવી છે (ગ્રાફ એટ અલ., 2016). GPR109A અભિવ્યક્તિ ડાયાબિટીક મોડલ, માનવ ડાયાબિટીક દર્દીઓ (ગંભીર એટ અલ., 2012), અને ન્યુરોડિજનરેશન દરમિયાન માઇક્રોગ્લિયામાં (Fu et al., 2014) ના RPE કોષોમાં વૃદ્ધિ પામે છે. ?OHB ની બળતરા વિરોધી અસરો RPE કોષોમાં GPR109A અતિશય અભિવ્યક્તિ દ્વારા ઉન્નત થાય છે, અને GPR109A (ગંભીર એટ અલ., 2012) ના ફાર્માકોલોજિકલ અવરોધ અથવા આનુવંશિક નોકઆઉટ દ્વારા રદ કરવામાં આવે છે. ?OHB અને એક્ઝોજેનસ નિકોટિનિક એસિડ (ટેગાર્ટ એટ અલ., 2005), બંને TNF માં બળતરા વિરોધી અસરો પ્રદાન કરે છે? અથવા એલપીએસ પ્રેરિત બળતરા પ્રો-ઇન્ફ્લેમેટરી પ્રોટીન (iNOS, COX-2), અથવા સ્ત્રાવિત સાઇટોકીન્સ (TNF?, IL-1?, IL-6, CCL2/MCP-1) ના સ્તરને ઘટાડીને, અંશતઃ એનએફને અવરોધિત કરીને. -?બી ટ્રાન્સલોકેશન (ફુ એટ અલ., 2014; ગંભીર એટ અલ., 2012). ?OHB ER તણાવ અને NLRP3 બળતરા ઘટાડે છે, એન્ટીઑકિસડેટીવ તણાવ પ્રતિભાવને સક્રિય કરે છે (Bae et al., 2016; Youm et al., 2015). જો કે, ન્યુરોડીજનરેટિવ બળતરામાં, GPR109A-આશ્રિત ?OHB-મધ્યસ્થી રક્ષણમાં MAPK પાથવે સિગ્નલિંગ (દા.ત., ERK, JNK, p38) (Fu et al., 2014) જેવા બળતરા મધ્યસ્થીઓ સામેલ નથી, પરંતુ COX-1-આશ્રિત PGD2 ની જરૂર પડી શકે છે. ઉત્પાદન (રહેમાન એટ અલ., 2014). તે રસપ્રદ છે કે ઇસ્કેમિક સ્ટ્રોક મોડલ (રહેમાન એટ અલ., 109) માં ન્યુરોપ્રોટેક્ટીવ અસર કરવા માટે મેક્રોફેજ GPR2014A જરૂરી છે, પરંતુ અસ્થિ મજ્જામાંથી મેળવેલા મેક્રોફેજેસમાં NLRP3 બળતરાને રોકવા માટે OHB ની ક્ષમતા GPR109A માં નિર્ભર છે. ., 2015). જો કે મોટાભાગના અભ્યાસો ?OHB ને બળતરા વિરોધી અસરો સાથે જોડે છે, ?OHB પ્રો-ઈન્ફ્લેમેટરી હોઈ શકે છે અને વાછરડાના હિપેટોસાઈટ્સમાં લિપિડ પેરોક્સિડેશનના માર્કર્સને વધારી શકે છે (શી એટ અલ., 2014). OHB ની વિરોધી વિરુદ્ધ બળતરા વિરોધી અસરો આમ કોષ પ્રકાર, OHB સાંદ્રતા, એક્સપોઝર અવધિ અને સહ-મોડ્યુલેટરની હાજરી અથવા ગેરહાજરી પર આધાર રાખે છે.
?OHB થી વિપરીત, AcAc પ્રો-ઈન્ફ્લેમેટરી સિગ્નલિંગને સક્રિય કરી શકે છે. એલિવેટેડ AcAc, ખાસ કરીને ઉચ્ચ ગ્લુકોઝ સાંદ્રતા સાથે, એનએડીપીએચ ઓક્સિડેઝ/ઓક્સિડેટીવ સ્ટ્રેસ આશ્રિત પદ્ધતિ દ્વારા એન્ડોથેલિયલ સેલ ઈજાને વધુ તીવ્ર બનાવે છે (કનિકર્લા-મેરી અને જૈન, 2015). ડાયાબિટીક માતાઓની નાળમાં ઉચ્ચ AcAc સાંદ્રતા ઉચ્ચ પ્રોટીન ઓક્સિડેશન દર અને MCP-1 સાંદ્રતા (કુરેપા એટ અલ., 2012) સાથે સંકળાયેલી હતી. ડાયાબિટીસના દર્દીઓમાં ઉચ્ચ AcAc TNF સાથે સંકળાયેલું હતું? અભિવ્યક્તિ (જૈન એટ અલ., 2002), અને AcAc, પરંતુ નહીં ?OHB, પ્રેરિત TNF?, MCP-1 અભિવ્યક્તિ, ROS સંચય, અને U937 માનવ મોનોસાઇટ કોશિકાઓમાં ઘટાડો થયેલ સીએએમપી સ્તર (જૈન એટ અલ., 2002; કુરેપા એટ અલ ., 2012).
કેટોન બોડી આશ્રિત સિગ્નલિંગ અસાધારણ ઘટનાઓ વારંવાર માત્ર ઉચ્ચ કેટોન બોડી સાંદ્રતા (> 5 એમએમ) સાથે શરૂ થાય છે, અને અસ્પષ્ટ પદ્ધતિઓ દ્વારા કેટોનને પ્રો- અથવા બળતરા વિરોધી અસરો સાથે જોડતા ઘણા અભ્યાસોના કિસ્સામાં. વધુમાં, બળતરા પર ?OHB વિરુદ્ધ AcAc ની વિરોધાભાસી અસરોને કારણે અને AcAc/?OHB રેશિયોની મિટોકોન્ડ્રીયલ રેડોક્સ સંભવિતને પ્રભાવિત કરવાની ક્ષમતાને લીધે, સેલ્યુલર ફેનોટાઇપ્સ પર કેટોન બોડીની ભૂમિકાનું મૂલ્યાંકન કરતા શ્રેષ્ઠ પ્રયોગો AcAc અને ? OHB વિવિધ ગુણોત્તરમાં, અને વિવિધ સંચિત સાંદ્રતામાં [દા.ત., (સાઇટો એટ અલ., 2016)]. છેલ્લે, AcAc ને માત્ર લિથિયમ સોલ્ટ અથવા એથિલ એસ્ટર તરીકે વ્યાપારી રીતે ખરીદી શકાય છે જેને ઉપયોગ કરતા પહેલા બેઝ હાઇડ્રોલિસિસની જરૂર હોય છે. લિથિયમ કેશન સ્વતંત્ર રીતે સિગ્નલ ટ્રાન્સડક્શન કાસ્કેડને પ્રેરિત કરે છે (મંજી એટ અલ., 1995), અને AcAc anion લેબલ છે. છેલ્લે, રેસીમિક d/l-?OHB નો ઉપયોગ કરીને અભ્યાસ મૂંઝવણમાં મૂકે છે, કારણ કે માત્ર d-?OHB સ્ટીરિયોઈસોમરને AcAc માં ઓક્સિડાઇઝ કરી શકાય છે, પરંતુ d-?OHB અને l-?OHB દરેક GPR109A દ્વારા સંકેત આપી શકે છે, NLRP3 બળતરાને અટકાવે છે, અને લિપોજેનિક સબસ્ટ્રેટ તરીકે સેવા આપે છે.
કેટોન બોડીઝ, ઓક્સિડેટીવ સ્ટ્રેસ અને ન્યુરોપ્રોટેક્શન
ઓક્સિડેટીવ તણાવને સામાન્ય રીતે એવી સ્થિતિ તરીકે વ્યાખ્યાયિત કરવામાં આવે છે જેમાં વધુ પડતા ઉત્પાદન અને/અથવા અશક્ત નાબૂદીને કારણે ROS વધુ પ્રમાણમાં રજૂ થાય છે. એન્ટીઑકિસડન્ટ અને ઓક્સિડેટીવ તાણ ઘટાડવાની કેટોન બોડીની ભૂમિકાઓનું વિટ્રો અને વિવો બંનેમાં વ્યાપકપણે વર્ણન કરવામાં આવ્યું છે, ખાસ કરીને ન્યુરોપ્રોટેક્શનના સંદર્ભમાં. કારણ કે મોટાભાગના ચેતાકોષો ફેટી એસિડ્સમાંથી ઉચ્ચ-ઊર્જા ફોસ્ફેટ્સ અસરકારક રીતે ઉત્પન્ન કરતા નથી, પરંતુ જ્યારે કાર્બોહાઇડ્રેટ્સની અછત હોય ત્યારે કેટોન બોડીને ઓક્સિડાઇઝ કરે છે, કેટોન બોડીની ન્યુરોપ્રોટેક્ટીવ અસરો ખાસ કરીને મહત્વપૂર્ણ છે (કાહિલ જીએફ જુનિયર, 2006; એડમન્ડ એટ અલ., 1987; યાંગ એટ અલ., 1987). ઓક્સિડેટીવ સ્ટ્રેસ મોડલ્સમાં, BDH1 ઇન્ડક્શન અને SCOT સપ્રેશન સૂચવે છે કે કેટોન બોડી મેટાબોલિઝમને વિવિધ સેલ સિગ્નલિંગ, રેડોક્સ સંભવિત, અથવા મેટાબોલિક આવશ્યકતાઓને ટકાવી રાખવા માટે ફરીથી પ્રોગ્રામ કરી શકાય છે (નાગાઓ એટ અલ., 2016; ટિયુ એટ અલ., 2003).
કેટોન બોડી ચેતાકોષો અને કાર્ડિયોમાયોસાઇટ્સમાં સેલ્યુલર નુકસાન, ઈજા, મૃત્યુ અને નીચલા એપોપ્ટોસિસના ગ્રેડમાં ઘટાડો કરે છે (હેસેસ એટ અલ., 2008; માલૌફ એટ અલ., 2007; નાગાઓ એટ અલ., 2016; ટિયુ એટ અલ., 2003). આમંત્રિત પદ્ધતિઓ વૈવિધ્યસભર છે અને હંમેશા એકાગ્રતા સાથે રેખીય રીતે સંબંધિત નથી. ઓછી મિલિમોલર સાંદ્રતા (d અથવા l)-?OHB સ્કેવેન્જ આરઓએસ (હાઇડ્રોક્સિલ એનિઓન), જ્યારે AcAc અસંખ્ય આરઓએસ પ્રજાતિઓને સ્કેવેન્જ કરે છે, પરંતુ માત્ર તે જ સાંદ્રતા પર જે શારીરિક શ્રેણી (IC50 20�67 એમએમ) કરતાં વધી જાય છે (હેસેસ એટ અલ., 2008) . તેનાથી વિપરીત, ઇલેક્ટ્રોન ટ્રાન્સપોર્ટ ચેઇનની રેડોક્સ સંભવિતતા પર ફાયદાકારક પ્રભાવ એ સામાન્ય રીતે d-?OHB સાથે જોડાયેલી પદ્ધતિ છે. જ્યારે ત્રણેય કીટોન બોડીઝ (d/l-?OHB અને AcAc) એ ચેતાકોષીય કોષોના મૃત્યુમાં ઘટાડો કર્યો અને ગ્લાયકોલિસિસના રાસાયણિક નિષેધને કારણે આરઓએસ સંચય થયો, માત્ર d-?OHB અને AcAc એ ચેતાકોષીય ATP ઘટાડાને અટકાવ્યો. તેનાથી વિપરીત, વિવો મોડેલમાં હાઈપોગ્લાયકેમિકમાં, (d અથવા l)-?OHB, પરંતુ AcAc એ હિપ્પોકેમ્પલ લિપિડ પેરોક્સિડેશનને અટકાવ્યું નથી (હેસેસ એટ અલ., 2008; માલૌફ એટ અલ., 2007; મરોસી એટ અલ., 2016; મર્ફી, 2009 ; ટિયુ એટ અલ., 2003). ઉંદરોના વિવો અભ્યાસમાં કેટોજેનિક આહાર (87% kcal ચરબી અને 13% પ્રોટીન) એ એન્ટીઑકિસડન્ટ ક્ષમતાની ન્યુરોએનાટોમિકલ વિવિધતા દર્શાવી હતી (Ziegler et al., 2003), જ્યાં સૌથી વધુ ગહન ફેરફારો હિપ્પોકેમ્પસમાં જોવા મળ્યા હતા, જેમાં ગ્લુટાથિઓન પેરોક્સિડેઝ અને કુલ વધારો થયો હતો. એન્ટીઑકિસડન્ટ ક્ષમતાઓ.
કેટોજેનિક આહાર, કેટોન એસ્ટર્સ (કેટોજેનિક આહાર અને એક્ઝોજેનસ કેટોન બોડીઝનો ઉપચારાત્મક ઉપયોગ પણ જુઓ), અથવા ?ઓએચબી એડમિનિસ્ટ્રેશન ઇસ્કેમિક સ્ટ્રોક (રહેમાન એટ અલ., 2014); પાર્કિન્સન રોગ (Tieu et al., 2003); સેન્ટ્રલ નર્વસ સિસ્ટમ ઓક્સિજન ઝેરી જપ્તી (D'Agostino et al., 2013); એપીલેપ્ટીક સ્પાસમ (યમ એટ અલ., 2015); મિટોકોન્ડ્રીયલ એન્સેફાલોમિયોપેથી, લેક્ટિક એસિડોસિસ અને સ્ટ્રોક-જેવા (MELAS) એપિસોડ્સ સિન્ડ્રોમ (ફ્રે એટ અલ., 2016) અને અલ્ઝાઈમર રોગ (કુન્નેન અને ક્રોફોર્ડ, 2003; યીન એટ અલ., 2016). તેનાથી વિપરિત, તાજેતરના અહેવાલમાં મિટોકોન્ડ્રીયલ બાયોજેનેસિસ અને એન્ટીઑકિસડન્ટ સિગ્નેચર્સમાં વધારો હોવા છતાં, અસામાન્ય માઇટોકોન્ડ્રીયલ ડીએનએ રિપેરના ટ્રાન્સજેનિક માઉસ મોડેલમાં કેટોજેનિક આહાર દ્વારા ન્યુરોડિજનરેટિવ પ્રગતિના હિસ્ટોપેથોલોજિકલ પુરાવા દર્શાવવામાં આવ્યા છે (લોરિટઝેન એટ અલ., 2016). અન્ય વિરોધાભાસી અહેવાલો સૂચવે છે કે ઉચ્ચ કેટોન બોડી સાંદ્રતાના સંપર્કમાં ઓક્સિડેટીવ તણાવ ઉત્પન્ન થાય છે. ઉચ્ચ ?OHB અથવા AcAc ડોઝ પ્રેરિત નાઈટ્રિક ઑકસાઈડ સ્ત્રાવ, લિપિડ પેરોક્સિડેશન, SOD ની અભિવ્યક્તિમાં ઘટાડો, ગ્લુટાથિઓન પેરોક્સિડેઝ અને કેટાલેઝ વાછરડાના હેપેટોસાઈટ્સમાં, જ્યારે ઉંદર હેપેટોસાઈટ્સમાં MAPK પાથવે ઇન્ડક્શન AcAc ને આભારી હતું પરંતુ ?OHB2004, del2014 (ઓએચબી) નહીં. ; શી એટ અલ., 2016; શી એટ અલ., XNUMX).
એકસાથે લેવામાં આવે તો, મોટા ભાગના અહેવાલો ?OHB ને ઓક્સિડેટીવ તણાવના એટેન્યુએશન સાથે જોડે છે, કારણ કે તેનો વહીવટ ROS/સુપરઓક્સાઇડના ઉત્પાદનને અટકાવે છે, લિપિડ પેરોક્સિડેશન અને પ્રોટીન ઓક્સિડેશનને અટકાવે છે, એન્ટીઑકિસડન્ટ પ્રોટીન સ્તરમાં વધારો કરે છે, અને મિટોકોન્ડ્રીયલ શ્વસન અને ATP ઉત્પાદનમાં સુધારો કરે છે (અબ્દેલમેગીડ એટ અલ.; 2004; હેસેસ એટ અલ., 2008; જૈન એટ અલ., 1998; જૈન એટ અલ., 2002; કનિકર્લા-મેરી અને જૈન, 2015; માલૌફ એટ અલ., 2007; માલૌફ અને રો, 2008; મરોસી એટ અલ., 2016 એટ અલ., 2003; યીન એટ અલ., 2016; ઝિગલર એટ અલ., 2003). જ્યારે AcAc ને ઓક્સિડેટીવ સ્ટ્રેસના ઇન્ડક્શન સાથે OHB કરતાં વધુ સીધો સંબંધ છે, ત્યારે આ અસરો હંમેશા સંભવિત પ્રો-ઈન્ફ્લેમેટરી પ્રતિભાવોથી સરળતાથી વિખેરી નાખવામાં આવતી નથી (જૈન એટ અલ., 2002; કનિકર્લા-મેરી અને જૈન, 2015; કનિકર્લા-મેરી અને જૈન, 2016). તદુપરાંત, તે ધ્યાનમાં લેવું મહત્વપૂર્ણ છે કે પ્લેયોટ્રોપિક કેટોજેનિક આહાર દ્વારા આપવામાં આવતો દેખીતો એન્ટીઑકિસડેટીવ લાભ પોતે કેટોન બોડી દ્વારા ટ્રાન્સડ્યુસ થઈ શકતો નથી, અને કેટોન બોડી દ્વારા આપવામાં આવેલ ન્યુરોપ્રોટેક્શન સંપૂર્ણપણે ઓક્સિડેટીવ તણાવને આભારી હોઈ શકે નહીં. ઉદાહરણ તરીકે, ગ્લુકોઝની વંચિતતા દરમિયાન, કોર્ટીકલ ચેતાકોષોમાં ગ્લુકોઝની વંચિતતાના મોડેલમાં, ?OHB એ ઓટોફેજિક પ્રવાહને ઉત્તેજિત કર્યો અને ઓટોફેગોસોમ સંચયને અટકાવ્યો, જે ન્યુરોનલ મૃત્યુમાં ઘટાડો સાથે સંકળાયેલ હતો (કેમ્બેરોસ-લુના એટ અલ., 2016). d-?OHB એ કેનોનિકલ એન્ટીઑકિસડન્ટ પ્રોટીન FOXO3a, SOD, MnSOD અને કેટાલેઝને પણ પ્રેરિત કરે છે, સંભવિતપણે HDAC નિષેધ દ્વારા (નાગાઓ એટ અલ., 2016; શિમાઝુ એટ અલ., 2013).
નોન-આલ્કોહોલિક ફેટી લિવર ડિસીઝ (NAFLD) અને કેટોન બોડી મેટાબોલિઝમ
સ્થૂળતા-સંબંધિત NAFLD અને નોન-આલ્કોહોલિક સ્ટીટોહેપેટાઇટિસ (NASH) એ પશ્ચિમી દેશોમાં યકૃત રોગના સૌથી સામાન્ય કારણો છે (Rinella and Sanyal, 2016), અને NASH-પ્રેરિત યકૃત નિષ્ફળતા એ યકૃત પ્રત્યારોપણ માટેના સૌથી સામાન્ય કારણોમાંનું એક છે. જ્યારે યકૃતના વજનના 5% કરતાં વધુ હિપેટોસાઇટ્સ (NAFL)માં ટ્રાયસીલગ્લિસેરોલ્સનો વધારાનો સંગ્રહ એકલા યકૃતના કાર્યને ડિજનરેટિવનું કારણ નથી આપતું, મનુષ્યોમાં NAFLD ની પ્રગતિ પ્રણાલીગત ઇન્સ્યુલિન પ્રતિકાર અને પ્રકાર 2 ડાયાબિટીસના વધતા જોખમ સાથે સંકળાયેલ છે, અને પેથોજેનેસિસમાં ફાળો આપી શકે છે. કાર્ડિયોવેસ્ક્યુલર ડિસીઝ અને ક્રોનિક કિડની ડિસીઝ (ફેબ્રિની એટ અલ., 2009; ટાર્ગેર એટ અલ., 2010; ટાર્ગેર અને બાયર્ન, 2013). NAFLD અને NASH ની પેથોજેનિક મિકેનિઝમ્સ અપૂર્ણ રીતે સમજી શકાય છે પરંતુ તેમાં હિપેટોસાઇટ મેટાબોલિઝમ, હેપેટોસાઇટ ઓટોફેજી અને એન્ડોપ્લાઝમિક રેટિક્યુલમ સ્ટ્રેસ, હેપેટિક ઇમ્યુન સેલ ફંક્શન, એડિપોઝ ટીશ્યુ ઇન્ફ્લેમેશન અને સિસ્ટમિક ઇન્ફ્લેમેટરી મિડિયેટર્સનો સમાવેશ થાય છે. ; ટાર્ગેર એટ અલ., 2009; યાંગ એટ અલ., 2013). કાર્બોહાઇડ્રેટ, લિપિડ અને એમિનો એસિડ ચયાપચયની વિક્ષેપ મનુષ્યોમાં અને મોડેલ સજીવોમાં સ્થૂળતા, ડાયાબિટીસ અને એનએએફએલડીમાં થાય છે અને તેમાં યોગદાન આપે છે [(ફેરેસ એટ અલ., 2010; લિન અને એક્સીલી, 2010; ન્યુગાર્ડ, 2012; સેમ્યુઅલ અને શુલમેન, 2011; સન એન્ડ લાઝર, 2012)]. જ્યારે સાયટોપ્લાઝમિક લિપિડ ચયાપચયમાં હિપેટોસાઇટ અસાધારણતા સામાન્ય રીતે NAFLD (Fabbrini et al., 2012b) માં જોવા મળે છે, ત્યારે માઇટોકોન્ડ્રીયલ મેટાબોલિઝમની ભૂમિકા, જે ચરબીના ઓક્સિડેટીવ નિકાલને નિયંત્રિત કરે છે તે NAFLD પેથોજેનેસિસમાં ઓછી સ્પષ્ટ છે. મિટોકોન્ડ્રીયલ ચયાપચયની અસાધારણતા એનએએફએલડી/એનએએસએચ પેથોજેનેસિસમાં થાય છે અને તેમાં ફાળો આપે છે (હ્યોટીલેનેન એટ અલ., 2013; સર્વિડિયો એટ અલ., 2010; સર્વિડિયો એટ અલ., 2016; વેઇ એટ અલ., 2011). ત્યાં સામાન્ય છે (ફેલિગ એટ અલ., 2008; આઇઓઝો એટ અલ., 2008; કોલિયાકી એટ અલ., 1974; સતાપતિ એટ અલ., 2010; સતાપતિ એટ અલ., 2015; સની એટ અલ., 2015) પરંતુ સમાન નથી ( કોલિયાકી અને રોડેન, 2012; પેરી એટ અલ., 2011; રેક્ટર એટ અલ., 2013) સર્વસંમતિ કે, સાચા NASH, યકૃતના મિટોકોન્ડ્રીયલ ઓક્સિડેશનના વિકાસ પહેલા, અને ખાસ કરીને ચરબીનું ઓક્સિડેશન, સ્થૂળતા, પ્રણાલીગત ઇન્સ્યુલિનમાં વધારો થાય છે. , અને NAFLD. સંભવ છે કે જેમ જેમ NAFLD ની પ્રગતિ થાય છે તેમ, વ્યક્તિગત મિટોકોન્ડ્રિયામાં પણ ઓક્સિડેટીવ ક્ષમતાની વિજાતીયતા ઉભરી આવે છે, અને આખરે ઓક્સિડેટીવ કાર્ય ક્ષતિગ્રસ્ત બને છે (કોલિયાકી એટ અલ., 2016; રેક્ટર એટ અલ., 2010; સતાપતિ એટ અલ., 2015; સતાપતિ એટ અલ., 2010; ., 2008).
કેટોજેનેસિસનો ઉપયોગ ઘણીવાર હેપેટિક ચરબીના ઓક્સિડેશન માટે પ્રોક્સી તરીકે થાય છે. કેટોજેનેસિસની ક્ષતિઓ એનએએફએલડી પ્રાણીઓના નમૂનાઓમાં અને સંભવતઃ મનુષ્યોમાં આગળ વધે છે. અપૂર્ણ રીતે વ્યાખ્યાયિત પદ્ધતિઓ દ્વારા, હાયપરઇન્સ્યુલિનેમિયા કેટોજેનેસિસને દબાવી દે છે, સંભવતઃ દુર્બળ નિયંત્રણોની તુલનામાં હાઇપોકેટોનિમિયામાં ફાળો આપે છે (બર્ગમેન એટ અલ., 2007; બિકરટન એટ અલ., 2008; સતાપતિ એટ અલ., 2012; સની અલ. , 2009; વાઇસ એટ અલ., 2011). તેમ છતાં, NAFLD ની આગાહી કરવા માટે કેટોન બોડી સાંદ્રતાને પરિભ્રમણ કરવાની ક્ષમતા વિવાદાસ્પદ છે (M�nnist� et al., 2005; સન્યાલ એટ અલ., 2015). પ્રાણી મોડેલોમાં મજબૂત માત્રાત્મક ચુંબકીય રેઝોનન્સ સ્પેક્ટ્રોસ્કોપિક પદ્ધતિઓએ મધ્યમ ઇન્સ્યુલિન પ્રતિકાર સાથે કીટોન ટર્નઓવર દરમાં વધારો દર્શાવ્યો હતો, પરંતુ ઘટેલા દરો વધુ ગંભીર ઇન્સ્યુલિન પ્રતિકાર સાથે સ્પષ્ટ હતા (સતાપતિ એટ અલ., 2001; સની એટ અલ., 2012). ફેટી લીવર ધરાવતા મેદસ્વી મનુષ્યોમાં, કેટોજેનિક દર સામાન્ય છે (બિકરટન એટ અલ., 2010; સની એટ અલ., 2008), અને તેથી, હિપેટોસાયટ્સની અંદર ફેટી એસિડના વધેલા ભારને અનુલક્ષીને કેટોજેનેસિસના દરો ઘટે છે. પરિણામે, ?-ઓક્સિડેશન-પ્રાપ્ત એસિટિલ-CoA ને TCA ચક્રમાં ટર્મિનલ ઓક્સિડેશન તરફ નિર્દેશિત કરવામાં આવી શકે છે, ટર્મિનલ ઓક્સિડેશનમાં વધારો, એનાપ્લેરોસિસ/કેટાપ્લેરોસિસ દ્વારા ફોસ્ફોએનોલપાયર્યુવેટ-ચાલિત ગ્લુકોનોજેનેસિસ અને ઓક્સિડેટીવ તણાવ. Acetyl-CoA પણ સંભવતઃ સાઇટ્રેટ તરીકે મિટોકોન્ડ્રિયામાંથી નિકાસ કરે છે, જે લિપોજેનેસિસ (ફિગ. 2011) માટે પૂર્વવર્તી સબસ્ટ્રેટ છે (સતાપતિ એટ અલ., 4; સતાપતિ એટ અલ., 2015; સોલિનાસ એટ અલ., 2012). જ્યારે કેટોજેનેસિસ લાંબા સમય સુધી સ્થૂળતા સાથે ઇન્સ્યુલિન અથવા ઉપવાસ માટે ઓછું પ્રતિભાવશીલ બને છે (સતાપતિ એટ અલ., 2015), તેની અંતર્ગત પદ્ધતિઓ અને ડાઉનસ્ટ્રીમ પરિણામો અપૂર્ણ રીતે સમજી શકાય છે. તાજેતરના પુરાવા સૂચવે છે કે mTORC2012 કેટોજેનેસિસને એવી રીતે દબાવી દે છે જે ઇન્સ્યુલિન સિગ્નલિંગ (કુસેજોવા એટ અલ., 1) ના ડાઉનસ્ટ્રીમ હોઈ શકે છે, જે અવલોકનો સાથે સુસંગત છે કે mTORC2016 PPAR?-મધ્યસ્થી Hmgcs1 ઇન્ડક્શન (સેનગુપ્તા એટ અલ. 2,) ને અટકાવે છે. HMGCS2010 અને SCOT/OXCT2નું નિયમન પણ જુઓ).

અમારા જૂથના પ્રારંભિક અવલોકનો કેટોજેનિક અપૂર્ણતાના પ્રતિકૂળ હિપેટિક પરિણામો સૂચવે છે (કોટર એટ અલ., 2014). કાર્બોહાઇડ્રેટથી ભરપૂર અને આ રીતે બિન-કેટોજેનિક સ્થિતિમાં પણ, અસામાન્ય ગ્લુકોઝ ચયાપચયમાં ફાળો આપે છે અને સ્ટીટોહેપેટાઇટિસ ઉશ્કેરે છે તેવી પૂર્વધારણાને ચકાસવા માટે, અમે ચિહ્નિત કીટોજેનિક અપૂર્ણતાનું માઉસ મોડેલ બનાવ્યું છે. Hmgcs2. સ્ટાન્ડર્ડ ઓછી ચરબીવાળા ચાઉ-ફીડ પુખ્ત ઉંદરોમાં HMGCS2 ની ખોટ હળવા હાઈપરગ્લાયકેમિઆનું કારણ બને છે અને સેંકડો યકૃતના ચયાપચયના ઉત્પાદનમાં નોંધપાત્ર વધારો થાય છે, જેમાંથી એક સ્યુટ લિપોજેનેસિસ સક્રિયકરણનું ભારપૂર્વક સૂચન કરે છે. અપર્યાપ્ત કેટોજેનેસિસ સાથે ઉંદરોને ઉચ્ચ ચરબીયુક્ત ખોરાક આપવાથી વ્યાપક હિપેટોસાઇટ ઇજા અને બળતરા થાય છે. આ તારણો કેન્દ્રીય પૂર્વધારણાઓને સમર્થન આપે છે કે (i) કેટોજેનેસિસ એ નિષ્ક્રિય ઓવરફ્લો પાથવે નથી પરંતુ યકૃત અને સંકલિત શારીરિક હોમિયોસ્ટેસિસમાં ગતિશીલ નોડ છે, અને (ii) NAFLD/NASH અને અવ્યવસ્થિત હેપેટિક ગ્લુકોઝ ચયાપચયને ઘટાડવા માટે સમજદાર કેટોજેનિક વૃદ્ધિ છે. .
ક્ષતિગ્રસ્ત કેટોજેનેસિસ યકૃતની ઇજા અને બદલાયેલ ગ્લુકોઝ હોમિયોસ્ટેસિસમાં કેવી રીતે ફાળો આપી શકે છે? પ્રથમ વિચારણા એ છે કે શું ગુનેગાર કેટોજેનિક પ્રવાહની ઉણપ છે અથવા કેટોન્સ પોતે છે. તાજેતરનો અહેવાલ સૂચવે છે કે કેટોન સંસ્થાઓ n-3 પોલીઅનસેચ્યુરેટેડ ફેટી એસિડ્સ (પાવલક એટ અલ., 2015) ના પ્રતિભાવમાં ઓક્સિડેટીવ તણાવ-પ્રેરિત યકૃતની ઇજાને ઘટાડી શકે છે. યાદ કરો કે હેપેટોસાયટ્સમાં SCOT અભિવ્યક્તિના અભાવને કારણે, કેટોન બોડી ઓક્સિડાઇઝ્ડ નથી, પરંતુ તેઓ લિપોજેનેસિસમાં ફાળો આપી શકે છે અને તેમના ઓક્સિડેશનથી સ્વતંત્ર વિવિધ સિગ્નલિંગ ભૂમિકાઓ પૂરી પાડે છે (કેટોન બોડીઝના નોન-ઓક્સિડેટીવ મેટાબોલિક ફેટ્સ પણ જુઓ અને ? OHB તરીકે સિગ્નલિંગ મધ્યસ્થી). તે પણ શક્ય છે કે હેપેટોસાઇટ-ઉત્પાદિત કીટોન બોડીઓ સ્ટેલેટ કોશિકાઓ અને કુફર સેલ મેક્રોફેજેસ સહિત, હિપેટિક એસિનસની અંદરના પડોશી કોષોના પ્રકારો માટે સિગ્નલ અને/અથવા મેટાબોલાઇટ તરીકે સેવા આપી શકે છે. જ્યારે ઉપલબ્ધ મર્યાદિત સાહિત્ય સૂચવે છે કે મેક્રોફેજ કેટોન બોડીને ઓક્સિડાઇઝ કરવામાં અસમર્થ છે, આ માત્ર શાસ્ત્રીય પદ્ધતિઓનો ઉપયોગ કરીને માપવામાં આવ્યું છે, અને માત્ર પેરીટોનિયલ મેક્રોફેજેસમાં (ન્યૂશોલ્મ એટ અલ., 1986; ન્યૂઝહોલ્મ એટ અલ., 1987), જે દર્શાવે છે કે પુનઃપ્રાપ્તિ અસ્થિમજ્જામાંથી મેળવેલા મેક્રોફેજેસમાં વિપુલ પ્રમાણમાં SCOT અભિવ્યક્તિને જોતાં મૂલ્યાંકન યોગ્ય છે (Youm et al., 2015).
હેપેટોસાઇટ કેટોજેનિક પ્રવાહ પણ સાયટોપ્રોટેક્ટીવ હોઈ શકે છે. જ્યારે સલામભર્યા મિકેનિઝમ્સ પ્રતિ સે કેટોજેનેસિસ પર નિર્ભર ન હોઈ શકે, ઓછા કાર્બોહાઇડ્રેટ કેટોજેનિક આહાર NAFLD (બ્રાઉનિંગ એટ અલ., 2011; ફોસ્ટર એટ અલ., 2010; કાની એટ અલ., 2014; શુગર અને ક્રોફોર્ડ, 2012) ના સુધારણા સાથે સંકળાયેલા છે. . અમારા અવલોકનો સૂચવે છે કે હેપેટોસાઇટ કેટોજેનેસિસ ટીસીએ ચક્ર પ્રવાહ, એનાપ્લેરોટિક પ્રવાહ, ફોસ્ફોએનોલપીરુવેટ-ડેરિવ્ડ ગ્લુકોનોજેનેસિસ (કોટર એટ અલ., 2014), અને ગ્લાયકોજેન ટર્નઓવરને પણ પ્રતિસાદ આપી શકે છે અને તેનું નિયમન કરી શકે છે. કેટોજેનિક ક્ષતિ એસીટીલ-કોએને ટીસીએ ફ્લક્સ વધારવા માટે નિર્દેશિત કરે છે, જે યકૃતમાં વધેલી ROS-મધ્યસ્થી ઇજા સાથે સંકળાયેલ છે (સતાપતિ એટ અલ., 2015; સતાપતિ એટ અલ., 2012); ડી નોવો સંશ્લેષિત લિપિડ પ્રજાતિઓમાં કાર્બનના ડાયવર્ઝનને દબાણ કરે છે જે સાયટોટોક્સિક સાબિત થઈ શકે છે; અને NAD+ (કોટર એટ અલ., 2014) (ફિગ. 4) માં NADH રી-ઓક્સિડેશનને અટકાવે છે. એકસાથે લેવામાં આવે તો, ભવિષ્યના પ્રયોગો એવી પદ્ધતિઓને સંબોધવા માટે જરૂરી છે કે જેના દ્વારા સંબંધિત કેટોજેનિક અપૂર્ણતા અયોગ્ય બની શકે છે, હાઈપરગ્લાયકેમિઆમાં ફાળો આપી શકે છે, સ્ટીટોહેપેટાઇટિસને ઉત્તેજિત કરી શકે છે અને શું આ પદ્ધતિઓ માનવ NAFLD/NASH માં કાર્યરત છે કે કેમ. જેમ કે રોગચાળાના પુરાવા સૂચવે છે કે સ્ટીટોહેપેટાઇટિસની પ્રગતિ દરમિયાન ક્ષતિગ્રસ્ત કીટોજેનેસિસ (એમ્બેડ એટ અલ., 2016; મેરિનોઉ એટ અલ., 2011; મન્નિસ્ટ� એટ અલ., 2015; પ્રમફાલ્ક એટ અલ., 2015; સફાઈ એટ અલ., 2016) હીપેટિક કેટોજેનેસિસમાં વધારો કરતી ઉપચારો લાભદાયી સાબિત થઈ શકે છે (ડિગિરોલામો એટ અલ., 2016; હોન્ડા એટ અલ., 2016).
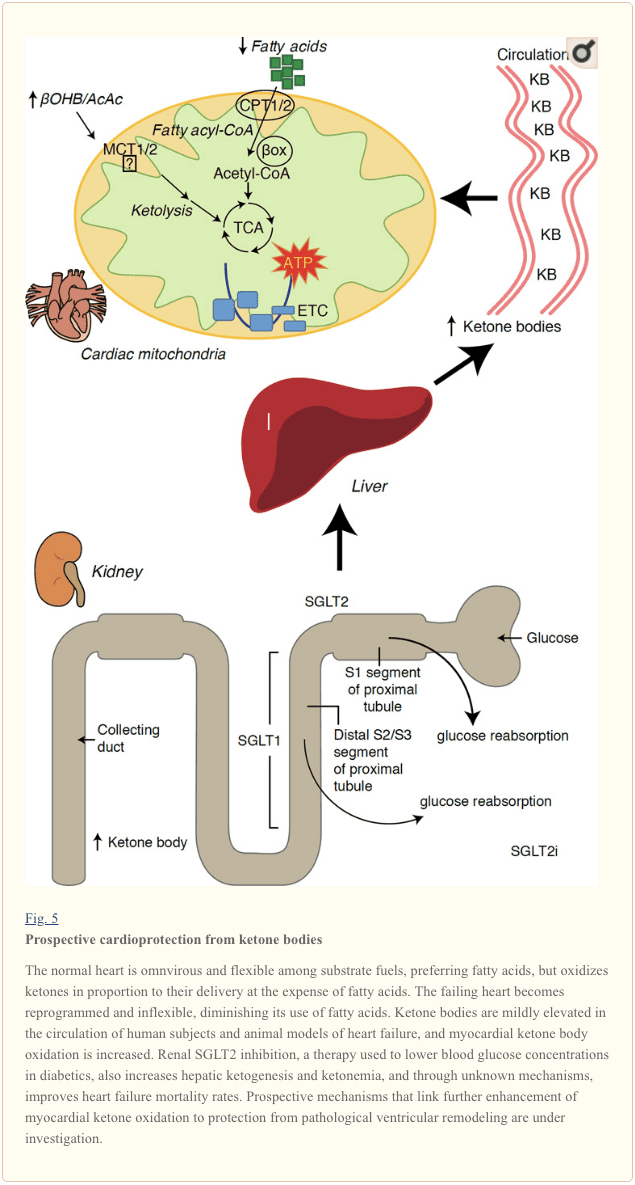
કેટોન બોડીઝ અને હાર્ટ ફેલ્યોર (HF)
મેટાબોલિક રેટ 400 kcal/kg/day કરતાં વધી જાય છે અને 6�35 kg ATP/દિવસના ટર્નઓવર સાથે, હૃદય સૌથી વધુ ઉર્જા ખર્ચ અને ઓક્સિડેટીવ માંગ સાથેનું અંગ છે (અશરફિયન એટ અલ., 2007; વાંગ એટ અલ., 2010b). મ્યોકાર્ડિયલ એનર્જી ટર્નઓવરનો મોટા ભાગનો હિસ્સો મિટોકોન્ડ્રિયાની અંદર રહે છે, અને આ પુરવઠાનો 70% FAO માંથી ઉદ્ભવે છે. સામાન્ય સ્થિતિમાં હૃદય સર્વભક્ષી અને લવચીક હોય છે, પરંતુ પેથોલોજીકલી રિમોડેલિંગ હૃદય (દા.ત., હાયપરટેન્શન અથવા મ્યોકાર્ડિયલ ઇન્ફાર્ક્શનને કારણે) અને ડાયાબિટીક હૃદય દરેક ચયાપચયની રીતે અણગમતું બની જાય છે (બાલાસે અને ફેરી, 1989; BING, 1954; ફુકાઓ એટ અલ., 2004 ; લોપાશુક એટ અલ., 2010; ટેગટમેયર એટ અલ., 1980; ટેગટમેયર એટ અલ., 2002; યંગ એટ અલ., 2002). ખરેખર, માઉસ મૉડલમાં કાર્ડિયાક ફ્યુઅલ મેટાબોલિઝમની આનુવંશિક રીતે પ્રોગ્રામ કરેલી અસાધારણતા કાર્ડિયોમાયોપથીને ઉત્તેજિત કરે છે (કાર્લી એટ અલ., 2014; ન્યુબાઉર, 2007). શારીરિક પરિસ્થિતિઓમાં સામાન્ય હૃદય ફેટી એસિડ અને ગ્લુકોઝ ઓક્સિડેશનના ખર્ચે તેમના ડિલિવરીના પ્રમાણમાં કેટોન બોડીને ઓક્સિડાઇઝ કરે છે, અને મ્યોકાર્ડિયમ એ યુનિટ માસ દીઠ સૌથી વધુ કીટોન બોડી ગ્રાહક છે (BING, 1954; ક્રોફોર્ડ એટ અલ., 2009; ગારલેન્ડ એટ અલ. ., 1962; હેસલબેંક એટ અલ., 2003; જેફરી એટ અલ., 1995; પેલેટિયર એટ અલ., 2007; ટાર્ડિફ એટ અલ., 2001; યાન એટ અલ., 2009). ફેટી એસિડ ઓક્સિડેશનની તુલનામાં, કેટોન બોડી વધુ ઉર્જાથી કાર્યક્ષમ હોય છે, રોકાણ કરાયેલા ઓક્સિજનના પરમાણુ (P/O રેશિયો) દીઠ ATP સંશ્લેષણ માટે ઉપલબ્ધ વધુ ઉર્જા આપે છે (કાશિવાયા એટ અલ., 2010; સાટો એટ અલ., 1995; વીચ, 2004) . કેટોન બોડી ઓક્સિડેશન પણ યુબીક્વિનોન ઓક્સિડાઇઝ્ડ રાખીને, એફએઓ કરતાં સંભવિત રીતે વધુ ઉર્જા આપે છે, જે ઇલેક્ટ્રોન ટ્રાન્સપોર્ટ ચેઇનમાં રેડોક્સ ગાળાને વધારે છે અને એટીપી (સાટો એટ અલ., 1995; વીચ, 2004)ને સંશ્લેષણ કરવા માટે વધુ ઊર્જા ઉપલબ્ધ કરાવે છે. કેટોન બોડીનું ઓક્સિડેશન પણ ROS ઉત્પાદનમાં ઘટાડો કરી શકે છે, અને આમ ઓક્સિડેટીવ તણાવ (Veech, 2004).
પ્રારંભિક હસ્તક્ષેપ અને અવલોકન અભ્યાસો હૃદયમાં કેટોન બોડીની સંભવિત મહત્વની ભૂમિકા સૂચવે છે. પ્રાયોગિક ઇસ્કેમિયા/રિપરફ્યુઝન ઇજાના સંદર્ભમાં, કેટોન બોડીએ સંભવિત કાર્ડિયોપ્રોટેક્ટીવ અસરો (અલ-ઝૈદ એટ અલ., 2007; વાંગ એટ અલ., 2008) પ્રદાન કરી, સંભવતઃ હૃદયમાં માઇટોકોન્ડ્રીયલ વિપુલતામાં વધારો અથવા નિર્ણાયક ઓક્સિડેટીવ ફોલોડેશનના અપ-રેગ્યુલેશનને કારણે. મધ્યસ્થીઓ (Snorek et al., 2012; Zou et al., 2002). તાજેતરના અભ્યાસો દર્શાવે છે કે ઉંદર (ઓબર્ટ એટ અલ., 2016) અને માનવીઓ (બેદી એટ અલ., 2016) ના નિષ્ફળ હૃદયમાં કેટોન બોડીનો ઉપયોગ વધ્યો છે, જે મનુષ્યોમાં અગાઉના અવલોકનોને સમર્થન આપે છે (BING, 1954; Fukao et al., 2000; જનાર્દન એટ અલ., 2011; લોન્ગો એટ અલ., 2004; રૂડોલ્ફ અને શિન્ઝ, 1973; ટિલ્ડન અને કોર્નબ્લાથ, 1972). હૃદયની નિષ્ફળતાના દર્દીઓમાં પરિભ્રમણ કરતા કેટોન શરીરની સાંદ્રતામાં વધારો થાય છે, દબાણ ભરવાના સીધા પ્રમાણમાં, અવલોકનો જેની પદ્ધતિ અને મહત્વ અજ્ઞાત રહે છે (કુપારી એટ અલ., 1995; લોમ્મી એટ અલ., 1996; લોમી એટ અલ., 1997; નીલી એટ અલ. ., 1972), પરંતુ કાર્ડિયોમાયોસાઇટ્સમાં પસંદગીયુક્ત SCOT ઉણપ ધરાવતા ઉંદરો સર્જિકલ પ્રેરિત દબાણ ઓવરલોડ ઇજાના પ્રતિભાવમાં ઝડપી પેથોલોજીકલ વેન્ટ્રિક્યુલર રિમોડેલિંગ અને ROS સહી દર્શાવે છે (Schugar et al., 2014).
ડાયાબિટીસ થેરાપીમાં તાજેતરના રસપ્રદ અવલોકનોએ મ્યોકાર્ડિયલ કેટોન મેટાબોલિઝમ અને પેથોલોજીકલ વેન્ટ્રિક્યુલર રિમોડેલિંગ (ફિગ. 5) વચ્ચે સંભવિત લિંક જાહેર કરી છે. રેનલ પ્રોક્સિમલ ટ્યુબ્યુલર સોડિયમ/ગ્લુકોઝ કો-ટ્રાન્સપોર્ટર 2 (SGLT2i) નું નિષેધ માનવોમાં પરિભ્રમણ કરતી કેટોન બોડી સાંદ્રતામાં વધારો કરે છે (ફેરાનીની એટ અલ., 2016a; ઇનાગાકી એટ અલ., 2015) અને ઉંદર (સુઝુકી એટ અલ., 2014) હેપેટિક કેટોજેનેસિસ (ફેરાનીની એટ અલ., 2014; ફેરાનીની એટ અલ., 2016a; કેટ્ઝ અને લીટર, 2015; મુદલિયાર એટ અલ., 2015). આશ્ચર્યજનક રીતે, આમાંના ઓછામાં ઓછા એક એજન્ટે HF હોસ્પિટલમાં દાખલ થવામાં ઘટાડો કર્યો (દા.ત., EMPA-REG OUTCOME ટ્રાયલ દ્વારા જાહેર કરાયેલ), અને કાર્ડિયોવેસ્ક્યુલર મૃત્યુદરમાં સુધારો થયો (ફિચેટ એટ અલ., 2016; સોનેસન એટ અલ., 2016; વુ એટ અલ., 2016a ; ઝિનમેન એટ અલ., 2015). જ્યારે લિંક્ડ SGLT2i માટે ફાયદાકારક HF પરિણામો પાછળના ડ્રાઇવર મિકેનિઝમ્સ સક્રિયપણે ચર્ચામાં રહે છે, ત્યારે સર્વાઇવલ બેનિફિટ બહુફેક્ટોરિયલ છે, જેમાં સંભવિતપણે કેટોસિસનો સમાવેશ થાય છે, પરંતુ વજન, બ્લડ પ્રેશર, ગ્લુકોઝ અને યુરિક એસિડના સ્તરો, ધમનીની જડતા, સહાનુભૂતિશીલ નર્વસ સિસ્ટમ પર ફાયદાકારક અસરો પણ છે. મૂત્રવર્ધક પદાર્થ/ઘટાડેલા પ્લાઝ્મા વોલ્યુમ, અને હિમેટોક્રિટમાં વધારો (રાઝ અને કેન, 2016; વલોન અને થોમસન, 2016). એકસાથે લેવામાં આવે તો, HF દર્દીઓમાં, અથવા HF વિકસાવવાનું ઉચ્ચ જોખમ ધરાવતા લોકોમાં ઉપચારાત્મક રીતે કેટોનેમિયા વધી રહ્યું છે તે ખ્યાલ વિવાદાસ્પદ રહે છે પરંતુ પ્રી-ક્લિનિકલ અને ક્લિનિકલ અભ્યાસમાં સક્રિય તપાસ હેઠળ છે (ફેરાનિની એટ અલ., 2016b; કોલવિઝ એટ અલ., 2016; લોપાશુક અને વર્મા, 2016; મુદલિયાર એટ અલ., 2016; ટેગટમેયર, 2016).
કેન્સર બાયોલોજીમાં કેટોન બોડીઝ
કેટોન બોડી અને કેન્સર વચ્ચેના જોડાણો ઝડપથી ઉભરી રહ્યા છે, પરંતુ પ્રાણીઓ અને માનવીઓ બંનેના અભ્યાસોએ વિવિધ તારણો આપ્યા છે. કારણ કે કેટોન ચયાપચય ગતિશીલ અને પોષક તત્ત્વોની સ્થિતિ પ્રતિભાવશીલ છે, તે ચોકસાઇ-માર્ગદર્શિત પોષક ઉપચારની સંભાવનાને કારણે કેન્સર સાથે જૈવિક જોડાણોને આગળ વધારવા માટે લલચાવે છે. કેન્સરના કોષો ઝડપી સેલ પ્રસાર અને વૃદ્ધિને જાળવી રાખવા માટે મેટાબોલિક રિપ્રોગ્રામિંગમાંથી પસાર થાય છે (DeNicola અને Cantley, 2015; Pavlova and Thompson, 2016). કેન્સર કોષ ચયાપચયમાં ક્લાસિકલ વોરબર્ગ અસર ઉર્જા સ્થાનાંતરિત કરવા અને ઓક્સિડેટીવ ફોસ્ફોરાયલેશન અને મર્યાદિત મિટોકોન્ડ્રીયલ શ્વસન પરની ઓછી અવલંબન માટે વળતર આપવા માટે ગ્લાયકોલિસિસ અને લેક્ટિક એસિડ આથોની પ્રબળ ભૂમિકામાંથી ઉદ્ભવે છે (ડી ફેયટર એટ અલ., 2016; ગ્રાબેકા એટ અલ., 2016; કાંગ એટ અલ., 2015; પોફ એટ અલ., 2014; શુક્લા એટ અલ., 2014). ગ્લુકોઝ કાર્બન મુખ્યત્વે ગ્લાયકોલિસિસ, પેન્ટોઝ ફોસ્ફેટ પાથવે અને લિપોજેનેસિસ દ્વારા નિર્દેશિત થાય છે, જે એકસાથે ટ્યુમર બાયોમાસ વિસ્તરણ માટે જરૂરી મધ્યસ્થીઓ પ્રદાન કરે છે (ગ્રેબકા એટ અલ., 2016; શુક્લા એટ અલ., 2014; યોશી એટ અલ., 2015). ગ્લુકોઝની વંચિતતા માટે કેન્સર કોશિકાઓનું અનુકૂલન એસીટેટ, ગ્લુટામાઇન અને એસ્પાર્ટેટ સહિત વૈકલ્પિક બળતણ સ્ત્રોતોનું શોષણ કરવાની ક્ષમતા દ્વારા થાય છે (જાવોર્સ્કી એટ અલ., 2016; સુલિવાન એટ અલ., 2015). ઉદાહરણ તરીકે, પાયરુવેટમાં પ્રતિબંધિત પ્રવેશ, કાર્બોક્સિલેશન દ્વારા ગ્લુટામાઇનને એસિટિલ-કોએમાં રૂપાંતરિત કરવાની કેન્સર કોશિકાઓની ક્ષમતા દર્શાવે છે, ઊર્જા અને એનાબોલિક બંને જરૂરિયાતો જાળવી રાખે છે (યાંગ એટ અલ., 2014). કેન્સરના કોષોનું એક રસપ્રદ અનુકૂલન એ એસિટેટનો બળતણ તરીકે ઉપયોગ છે (કોમરફોર્ડ એટ અલ., 2014; જવોર્સ્કી એટ અલ., 2016; માશિમો એટ અલ., 2014; રાઈટ અને સિમોન, 2016; યોશી એટ અલ., 2015). એસિટેટ એ લિપોજેનેસિસ માટે સબસ્ટ્રેટ પણ છે, જે ટ્યુમર સેલ પ્રસાર માટે મહત્વપૂર્ણ છે, અને આ લિપોજેનિક નળીનો લાભ દર્દીના ટૂંકા અસ્તિત્વ અને વધુ ગાંઠના બોજ સાથે સંકળાયેલ છે (કોમરફોર્ડ એટ અલ., 2014; માશિમો એટ અલ., 2014; યોશી એટ અલ. ., 2015).
ગ્લુકોઝના અભાવ દરમિયાન કેન્સર સિવાયના કોષો સરળતાથી તેમના ઉર્જા સ્ત્રોતને ગ્લુકોઝમાંથી કેટોન બોડીમાં સ્થાનાંતરિત કરે છે. આ પ્લાસ્ટિસિટી કેન્સરના કોષોના પ્રકારોમાં વધુ ચલ હોઈ શકે છે, પરંતુ વિવોમાં પ્રત્યારોપણ કરાયેલ મગજની ગાંઠો ઓક્સિડાઇઝ્ડ [2,4-13C2]-?OHB આસપાસના મગજની પેશીઓ જેટલી જ ડિગ્રી સુધી (ડી ફેટર એટ અલ., 2016). રિવર્સ વોરબર્ગ ઇફેક્ટ’ અથવા બે કમ્પાર્ટમેન્ટ ટ્યુમર મેટાબોલિઝમ’ મોડેલો એવી ધારણા કરે છે કે કેન્સરના કોષો નજીકના ફાઇબ્રોબ્લાસ્ટ્સમાં OHB ઉત્પાદનને પ્રેરિત કરે છે, ટ્યુમર સેલની ઊર્જા જરૂરિયાતો પૂરી પાડે છે (બોનુસેલી એટ અલ., 2010; માર્ટિનેઝ-આઉટસ્ચૂર્ન એટ અલ., 2012) . યકૃતમાં, હેપેટોસેલ્યુલર કાર્સિનોમા (હેપેટોમા) કોશિકાઓમાં કેટોજેનેસિસથી કેટોન ઓક્સિડેશન તરફ હિપેટોસાયટ્સમાં પરિવર્તન બે હિપેટોમા સેલ લાઇન (ઝાંગ એટ અલ., 1) માં જોવા મળેલી BDH1989 અને SCOT પ્રવૃત્તિઓના સક્રિયકરણ સાથે સુસંગત છે. ખરેખર, હિપેટોમા કોષો OXCT1 અને BDH1 ને વ્યક્ત કરે છે અને કેટોન્સને ઓક્સિડાઇઝ કરે છે, પરંતુ માત્ર ત્યારે જ જ્યારે સીરમ ભૂખ્યો હોય (હુઆંગ એટ અલ., 2016). વૈકલ્પિક રીતે, ટ્યુમર સેલ કીટોજેનેસિસની પણ દરખાસ્ત કરવામાં આવી છે. કેટોજેનિક જનીન અભિવ્યક્તિમાં ગતિશીલ પરિવર્તન કોલોનિક એપિથેલિયમના કેન્સરગ્રસ્ત રૂપાંતર દરમિયાન પ્રદર્શિત થાય છે, એક કોષ પ્રકાર જે સામાન્ય રીતે HMGCS2 ને વ્યક્ત કરે છે, અને તાજેતરના અહેવાલમાં સૂચવવામાં આવ્યું છે કે HMGCS2 એ કોલોરેક્ટલ અને સ્ક્વામસ સેલ કાર્સિનોમામાં નબળા પૂર્વસૂચનનું પ્રોગ્નોસ્ટિક માર્કર હોઈ શકે છે. 2006; ચેન એટ અલ., 2016). શું આ જોડાણમાં કેટોજેનેસિસ અથવા HMGCS2 ના મૂનલાઇટિંગ ફંક્શનની આવશ્યકતા છે કે તેનો સમાવેશ થાય છે, તે નક્કી કરવાનું બાકી છે. તેનાથી વિપરિત, મેલાનોમા અને ગ્લિઓબ્લાસ્ટોમા કોશિકાઓ દ્વારા દેખીતી ?ઓએચબી ઉત્પાદન, PPAR દ્વારા ઉત્તેજિત? એગોનિસ્ટ ફેનોફાઈબ્રેટ, વૃદ્ધિ ધરપકડ સાથે સંકળાયેલું હતું (ગ્રેબકા એટ અલ., 2016). કેન્સર કોશિકાઓમાં HMGCS2/SCOT અભિવ્યક્તિ, કેટોજેનેસિસ અને કેટોન ઓક્સિડેશનની ભૂમિકાઓ દર્શાવવા માટે વધુ અભ્યાસ જરૂરી છે.
ઇંધણ ચયાપચયના ક્ષેત્રની બહાર, કેટોન્સ તાજેતરમાં સિગ્નલિંગ મિકેનિઝમ દ્વારા કેન્સર સેલ બાયોલોજીમાં સામેલ કરવામાં આવ્યા છે. BRAF-V600E+ મેલાનોમાનું વિશ્લેષણ ઓન્કોજેનિક BRAF-આશ્રિત રીતે HMGCL ના OCT1-આશ્રિત ઇન્ડક્શન સૂચવે છે (કાંગ એટ અલ., 2015). HMGCL વૃદ્ધિ ઉચ્ચ સેલ્યુલર AcAc સાંદ્રતા સાથે સંકળાયેલી હતી, જે બદલામાં BRAFV600E-MEK1 ક્રિયાપ્રતિક્રિયામાં વધારો કરે છે, MEK-ERK સિગ્નલિંગને ફીડ-ફોરવર્ડ લૂપમાં વિસ્તૃત કરે છે જે ટ્યુમર સેલ પ્રસાર અને વૃદ્ધિને ચલાવે છે. આ અવલોકનો સંભવિત એક્સ્ટ્રાહેપેટિક કેટોજેનેસિસનો રસપ્રદ પ્રશ્ન ઉભો કરે છે જે પછી સિગ્નલિંગ મિકેનિઝમને સમર્થન આપે છે (પણ જુઓ ? OHB સિગ્નલિંગ મધ્યસ્થી તરીકે અને એક્સ્ટ્રાહેપેટિક કેટોજેનેસિસમાં વિવાદો). કેન્સર ચયાપચય પર AcAc, d-?OHB, અને l-?OHB ની સ્વતંત્ર અસરોને ધ્યાનમાં લેવી પણ મહત્વપૂર્ણ છે, અને HMGCL ને ધ્યાનમાં લેતી વખતે, લ્યુસિન અપચય પણ વિકૃત થઈ શકે છે.
કેટોજેનિક આહારની અસરો (કેટોજેનિક આહાર અને એક્ઝોજેનસ કેટોન બોડીનો ઉપચારાત્મક ઉપયોગ પણ જુઓ) કેન્સરના પ્રાણી મોડેલોમાં વિવિધ છે (ડી ફેયટર એટ અલ., 2016; ક્લેમેન્ટ એટ અલ., 2016; મેઇડનબાઉર એટ અલ., 2015; પોફ અલ. ., 2014; સેફ્રીડ એટ અલ., 2011; શુક્લા એટ અલ., 2014). જ્યારે સ્થૂળતા, કેન્સર અને કેટોજેનિક આહારો વચ્ચે રોગચાળાના જોડાણો પર ચર્ચા થઈ રહી છે (લિસ્કીવિઝ એટ અલ., 2016; રાઈટ અને સિમોન, 2016), પ્રાણીઓના નમૂનાઓમાં અને માનવીય અભ્યાસોમાં કેટોજેનિક આહારનો ઉપયોગ કરીને મેટા-વિશ્લેષણે જીવન ટકાવી રાખવા પર ફાયદાકારક અસર સૂચવી છે. કેટોસિસની તીવ્રતા, આહારની શરૂઆતનો સમય અને ગાંઠનું સ્થાન (ક્લેમેન્ટ એટ અલ., 2016; વૂલ્ફ એટ અલ., 2016) સાથે સંભવિતપણે જોડાયેલા લાભો. કેટોન બોડીઝ (d-?OHB અથવા AcAc) સાથે સ્વાદુપિંડના કેન્સરના કોષોની સારવારથી વૃદ્ધિ, પ્રસાર અને ગ્લાયકોલિસિસ અટકાવવામાં આવે છે અને કેટોજેનિક આહાર (81% kcal ચરબી, 18% પ્રોટીન, 1% કાર્બોહાઇડ્રેટ) વિવો ગાંઠના વજનમાં ઘટાડો, ગ્લાયસીમિયા અને પ્રત્યારોપણ કરાયેલ કેન્સરવાળા પ્રાણીઓમાં સ્નાયુ અને શરીરના વજનમાં વધારો (શુક્લા એટ અલ., 2014). ઉંદરમાં મેટાસ્ટેટિક ગ્લિઓબ્લાસ્ટોમા સેલ મોડલનો ઉપયોગ કરીને સમાન પરિણામો જોવા મળ્યા હતા જેમણે આહારમાં કેટોન પૂરક મેળવ્યું હતું (પોફ એટ અલ., 2014). તેનાથી વિપરિત, કેટોજેનિક આહાર (91% kcal ચરબી, 9% પ્રોટીન) પરિભ્રમણમાં વધારો કરે છે?OHB સાંદ્રતા અને ઘટાડો ગ્લાયસીમિયા, પરંતુ ગ્લિઓમા-બેરિંગ ઉંદરોમાં ટ્યુમરના જથ્થા અથવા અસ્તિત્વના સમયગાળા પર કોઈ અસર થતી નથી (ડી ફેટર એટ અલ., 2016). ગ્લુકોઝ કેટોન ઇન્ડેક્સ ક્લિનિકલ સૂચક તરીકે પ્રસ્તાવિત કરવામાં આવ્યો છે જે માનવો અને ઉંદરોમાં કેટોજેનિક આહાર-પ્રેરિત મગજ કેન્સર ઉપચારના મેટાબોલિક મેનેજમેન્ટને સુધારે છે (મેઇડનબૌર એટ અલ., 2015). કેન્સર બાયોલોજીમાં કેટોન બોડી મેટાબોલિઝમ અને કેટોન બોડીની ભૂમિકાઓ એકસાથે લેવામાં આવે છે કારણ કે તે પ્રત્યેક ટ્રેક્ટેબલ થેરાપ્યુટિક વિકલ્પો રજૂ કરે છે, પરંતુ મૂળભૂત પાસાઓ સ્પષ્ટ કરવાના બાકી છે, જેમાં (i) એક્સોજેનસ કેટોન વચ્ચેના તફાવતો સહિત ચલોના મેટ્રિક્સમાંથી સ્પષ્ટ પ્રભાવો બહાર આવે છે. શરીર વિરુદ્ધ કેટોજેનિક આહાર, (ii) કેન્સર સેલ પ્રકાર, જીનોમિક પોલીમોર્ફિઝમ્સ, ગ્રેડ અને સ્ટેજ; અને (iii) કેટોટિક અવસ્થાના સંપર્કમાં આવવાનો સમય અને અવધિ.

કેટોજેનેસિસ ફેટી એસિડ અને કેટોજેનિક એમિનો એસિડના ભંગાણ દ્વારા કેટોન બોડી દ્વારા બનાવવામાં આવે છે. આ બાયોકેમિકલ પ્રક્રિયા રક્ત ગ્લુકોઝની અનુપલબ્ધતાના પ્રતિભાવ તરીકે ઉપવાસના સંજોગોમાં વિવિધ અવયવો, ખાસ કરીને મગજને ઊર્જા પૂરી પાડે છે. કીટોન બોડી મુખ્યત્વે લીવર કોશિકાઓના મિટોકોન્ડ્રિયામાં ઉત્પન્ન થાય છે. જ્યારે અન્ય કોષો કેટોજેનેસિસ કરવા સક્ષમ હોય છે, તેઓ યકૃતના કોષો જેટલા અસરકારક નથી. કારણ કે કીટોજેનેસિસ મિટોકોન્ડ્રિયામાં થાય છે, તેની પ્રક્રિયાઓ સ્વતંત્ર રીતે નિયંત્રિત થાય છે. ડૉ. એલેક્સ જિમેનેઝ ડીસી, CCST ઇનસાઇટ
કેટોજેનિક આહાર અને એક્ઝોજેનસ કેટોન બોડીઝની ઉપચારાત્મક એપ્લિકેશન
થેરાપ્યુટિક સાધનો તરીકે કેટોજેનિક આહાર અને કેટોન બોડીનો ઉપયોગ સ્થૂળતા અને એનએએફએલડી/એનએએસએચ (બ્રાઉનિંગ એટ અલ., 2011; ફોસ્ટર એટ અલ., 2010; શુગર અને ક્રોફોર્ડ, 2012) સહિત બિન-કેન્સરયુક્ત સંદર્ભોમાં પણ ઉદ્ભવ્યો છે; હૃદયની નિષ્ફળતા (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); ન્યુરોલોજીકલ અને ન્યુરોડીજનરેટિવ રોગ (માર્ટિન એટ અલ., 2016; મેકનેલી અને હાર્ટમેન, 2012; રો, 2015; રોગાવસ્કી એટ અલ., 2016; યાંગ અને ચેંગ, 2010; યાઓ એટ અલ., 2011); મેટાબોલિઝમની જન્મજાત ભૂલો (સ્કોલ-બર્ગી એટ અલ, 2015); અને કસરત પ્રદર્શન (કોક્સ એટ અલ., 2016). કેટોજેનિક આહારની અસરકારકતા ખાસ કરીને વાઈના હુમલાના ઉપચારમાં, ખાસ કરીને ડ્રગ-પ્રતિરોધક દર્દીઓમાં પ્રશંસા કરવામાં આવી છે. મોટાભાગના અભ્યાસોએ બાળરોગના દર્દીઓમાં કેટોજેનિક આહારનું મૂલ્યાંકન કર્યું છે, અને પસંદગીના સિન્ડ્રોમ (વુ એટ અલ., 50b) માં સુધારેલ અસરકારકતા સાથે, 3 મહિના પછી હુમલાની આવર્તનમાં ~2016% સુધીનો ઘટાડો દર્શાવે છે. પુખ્ત વયના એપીલેપ્સીમાં અનુભવ વધુ મર્યાદિત છે, પરંતુ સમાન ઘટાડો લાક્ષાણિક સામાન્યકૃત વાઈના દર્દીઓમાં વધુ સારી પ્રતિક્રિયા સાથે સ્પષ્ટ છે (નેઇ એટ અલ., 2014). અંતર્ગત એન્ટિ-કન્વલ્સન્ટ મિકેનિઝમ્સ અસ્પષ્ટ રહે છે, જો કે અનુમાનિત પૂર્વધારણાઓમાં ઘટાડો ગ્લુકોઝ વપરાશ/ગ્લાયકોલીસીસ, પુનઃપ્રોગ્રામ કરેલ ગ્લુટામેટ પરિવહન, એટીપી-સંવેદનશીલ પોટેશિયમ ચેનલ અથવા એડેનોસિન A1 રીસેપ્ટર પર પરોક્ષ અસર, સોડિયમ ચેનલમાં ફેરફારનો સમાવેશ થાય છે. લેમ્બ્રેચ્ટ્સ એટ અલ., 2016; લિન એટ અલ., 2017; લુટાસ અને યેલેન, 2013). તે અસ્પષ્ટ છે કે શું એન્ટી-કન્વલ્સન્ટ અસર મુખ્યત્વે કેટોન બોડીને આભારી છે, અથવા ઓછા કાર્બોહાઇડ્રેટ આહારના કાસ્કેડ મેટાબોલિક પરિણામોને કારણે છે. તેમ છતાં, કેટોન એસ્ટર્સ (નીચે જુઓ) ઉશ્કેરાયેલા હુમલાના પ્રાણી મોડેલોમાં જપ્તી થ્રેશોલ્ડને વધારતા દેખાય છે (સિઅરલોન એટ અલ., 2016; ડી'એગોસ્ટિનો એટ અલ., 2013; વિગિયાનો એટ અલ., 2015).
એટકિન્સ-શૈલી અને કેટોજેનિક, નીચા કાર્બોહાઇડ્રેટ આહારને ઘણીવાર અપ્રિય માનવામાં આવે છે, અને તે કબજિયાત, હાયપર્યુરિસેમિયા, હાઇપોકેલેસીમિયા, હાઇપોમેગ્નેસીમિયા, નેફ્રોલિથિઆસિસ, કીટોએસિડોસિસ, હાઇપરગ્લાયકેમિઆનું કારણ બને છે અને ફરતા કોલેસ્ટ્રોલ અને ફ્રી ફેટી એસિડની સાંદ્રતામાં વધારો કરી શકે છે. ; કોસોફ અને હાર્ટમેન, 2001; ક્વિટેરોવિચ એટ અલ., 2012; સુઝુકી એટ અલ., 2003). આ કારણોસર, લાંબા ગાળાનું પાલન પડકારો ઉભો કરે છે. ઉંદરોના અભ્યાસો સામાન્ય રીતે વિશિષ્ટ મેક્રોન્યુટ્રિઅન્ટ વિતરણ (2002% kcal ચરબી, 94% kcal કાર્બોહાઇડ્રેટ, 1% kcal પ્રોટીન, Bio-Serv F5) નો ઉપયોગ કરે છે, જે મજબૂત કીટોસિસને ઉશ્કેરે છે. જો કે, પ્રોટીન સામગ્રીમાં વધારો, 3666% kcal સુધી પણ કીટોસિસને નોંધપાત્ર રીતે ઘટાડે છે, અને 10% kcal પ્રોટીન પ્રતિબંધ ગૂંચવણભરી ચયાપચય અને શારીરિક અસરો આપે છે. આ આહાર ફોર્મ્યુલેશન પણ કોલીન ડિપ્લેટેડ છે, અન્ય ચલ કે જે યકૃતની ઇજા માટે સંવેદનશીલતાને પ્રભાવિત કરે છે, અને તે પણ કેટોજેનેસિસ (ગાર્બો એટ અલ., 5; જોર્નાયવાઝ એટ અલ., 2011; કેનેડી એટ અલ., 2010; પીસિયોસ એટ અલ., 2007; એટ અલ., 2013). ઉંદરમાં કેટોજેનિક આહારના લાંબા ગાળાના વપરાશની અસરો અપૂર્ણ રીતે વ્યાખ્યાયિત રહે છે, પરંતુ ઉંદરમાં તાજેતરના અભ્યાસોએ તેમના જીવનકાળ દરમિયાન કેટોજેનિક આહાર પર ઉંદરમાં સામાન્ય અસ્તિત્વ અને યકૃતની ઇજાના માર્કર્સની ગેરહાજરી જાહેર કરી હતી, જોકે એમિનો એસિડ ચયાપચય, ઉર્જા ખર્ચ અને ઇન્સ્યુલિનના સંકેતો. નોંધપાત્ર રીતે પુનઃપ્રોગ્રામ કરવામાં આવ્યા હતા (Douris et al., 2013).
કેટોજેનિક આહારના વૈકલ્પિક મિકેનિઝમ દ્વારા કીટોસિસને વધારતી પદ્ધતિઓમાં ઇન્જેસ્ટેબલ કેટોન બોડી પ્રિકર્સર્સનો ઉપયોગ શામેલ છે. એક્ઝોજેનસ કેટોન બોડીનું સંચાલન એક અનન્ય શારીરિક સ્થિતિનું નિર્માણ કરી શકે છે જેનો સામાન્ય શરીરવિજ્ઞાનમાં સામનો ન થયો હોય, કારણ કે પરિભ્રમણ કરતી ગ્લુકોઝ અને ઇન્સ્યુલિન સાંદ્રતા પ્રમાણમાં સામાન્ય છે, જ્યારે કોષો ગ્લુકોઝના શોષણ અને ઉપયોગને બચાવી શકે છે. કેટોન બોડીઝનું પોતાનું અર્ધ જીવન ટૂંકું હોય છે, અને ઉપચારાત્મક કીટોસિસ હાંસલ કરવા માટે સોડિયમ ?OHB મીઠુંનું ઇન્જેશન અથવા ઇન્ફ્યુઝન એક અપ્રિય સોડિયમ લોડને ઉત્તેજિત કરે છે. R/S-1,3-butanediol એ બિન-ઝેરી ડાયલ આલ્કોહોલ છે જે d/l-?OHB (ડેસરોચેર્સ એટ અલ., 1992) મેળવવા માટે લીવરમાં સરળતાથી ઓક્સિડાઇઝ થાય છે. વિશિષ્ટ પ્રાયોગિક સંદર્ભોમાં, આ ડોઝ દરરોજ ઉંદર અથવા ઉંદરોને સાત અઠવાડિયા સુધી આપવામાં આવે છે, જે વહીવટના 5 કલાકની અંદર 2 એમએમ સુધીની OHB સાંદ્રતા આપે છે, જે ઓછામાં ઓછા વધારાના 3 કલાક (D') માટે સ્થિર છે. એગોસ્ટિનો એટ અલ., 2013). R/S-1,3-બ્યુટેનેડિઓલ (કાર્પેન્ટર અને ગ્રોસમેન, 1983) આપવામાં આવતા ઉંદરોમાં ખોરાકના સેવનનું આંશિક દમન જોવા મળ્યું છે. વધુમાં, ત્રણ રાસાયણિક રીતે અલગ કેટોન એસ્ટર્સ (KEs), (i) R-1,3-butanediol અને d-?OHB (R-3-hydroxybutyl R-?OHB); (ii) glyceryl-tris-?OHB; અને (iii) R,S-1,3-butanediol acetoacetate diester નો પણ વ્યાપકપણે અભ્યાસ કરવામાં આવ્યો છે (બ્રુનેનગ્રેબર, 1997; ક્લાર્ક એટ અલ., 2012a; ક્લાર્ક એટ અલ., 2012b; ડેસરોચેર્સ એટ અલ., 1995; અલ. ., 1995b; કાશીવાયા એટ અલ., 2010). પહેલાનો એક સ્વાભાવિક ફાયદો એ છે કે આંતરડા અથવા યકૃતમાં એસ્ટેરેઝ હાઇડ્રોલિસિસને પગલે, KE ના છછુંદર દીઠ શારીરિક ડી-?ઓએચબીના 2 મોલ્સ ઉત્પન્ન થાય છે. R-3-hydroxybutyl R-?OHB, 714 mg/kg સુધીના ડોઝ પર, 6 mM સુધી ફરતા d-?OHB સાંદ્રતા આપે છે (ક્લાર્ક એટ અલ. 2012a; કોક્સ એટ અલ., 2016; કેમ્પર એટ અલ., 2015; શિવવા એટ અલ., 2016). ઉંદરોમાં, આ KE કેલરીનું સેવન અને પ્લાઝ્મા કુલ કોલેસ્ટ્રોલ ઘટાડે છે, બ્રાઉન એડિપોઝ પેશીને ઉત્તેજિત કરે છે, અને ઇન્સ્યુલિન પ્રતિકાર સુધારે છે (કાશીવાયા એટ અલ., 2010; કેમ્પર એટ અલ., 2015; વીચ, 2013). તાજેતરના તારણો દર્શાવે છે કે પ્રશિક્ષિત એથ્લેટ્સમાં કસરત દરમિયાન, R-3-hydroxybutyl R-?OHB ઇન્જેશનથી હાડપિંજરના સ્નાયુ ગ્લાયકોલિસિસ અને પ્લાઝ્મા લેક્ટેટ સાંદ્રતામાં ઘટાડો થયો હતો, ઇન્ટ્રામસ્ક્યુલર ટ્રાયસીલગ્લિસરોલ ઓક્સિડેશનમાં વધારો થયો હતો અને સ્નાયુ ગ્લાયકોજેનનું પ્રમાણ સાચવવામાં આવ્યું હતું, ત્યારે પણ જ્યારે સહ-ઇન્ગસ્ટેડ કાર્બોહાઇડ્રેટ કાર્બોહાઇડ્રેટ્સ (એસટીએમ) કોક્સ એટ અલ., 2016). આ રસપ્રદ પરિણામોના વધુ વિકાસની જરૂર છે, કારણ કે સહનશક્તિ કસરત પ્રદર્શનમાં સુધારો મુખ્યત્વે 2/8 વિષયોમાં KE ને મજબૂત પ્રતિસાદ દ્વારા ચલાવવામાં આવ્યો હતો. તેમ છતાં, આ પરિણામો શાસ્ત્રીય અભ્યાસોને સમર્થન આપે છે જે અન્ય સબસ્ટ્રેટ પર કેટોન ઓક્સિડેશન માટે પસંદગી સૂચવે છે (GARLAND et al., 1962; Hasselbaink et al., 2003; Stanley et al., 2003; Valente-Silva et al., 2015), વ્યાયામ દરમિયાનનો સમાવેશ થાય છે, અને તે પ્રશિક્ષિત એથ્લેટ્સ કીટોન્સનો ઉપયોગ કરવા માટે વધુ પ્રાઇમ હોઈ શકે છે (જહોનસન એટ અલ., 1969a; જોહ્ન્સન અને વોલ્ટન, 1972; વિન્ડર એટ અલ., 1974; વિન્ડર એટ અલ., 1975). છેવટે, સમાન કેલરીના સેવન (મેક્રોન્યુટ્રિઅન્ટ્સ વચ્ચે વિભેદક રીતે વિતરિત) અને સમાન ઓક્સિજન વપરાશ દરોને પગલે કસરતની સુધારેલી કામગીરીને સમર્થન આપી શકે તેવી પદ્ધતિઓ નક્કી કરવાની બાકી છે.
ભાવિ પરિપ્રેક્ષ્ય
એકવાર કાર્બોહાઇડ્રેટ પ્રતિબંધિત રાજ્યોમાં ચરબીના દહનથી ઝેરી ઉત્સર્જન એકઠા કરવામાં સક્ષમ ઓવરફ્લો પાથવે તરીકે મોટાભાગે કલંકિત થઈ ગયા (કેટોટોક્સિક’ દાખલા), તાજેતરના અવલોકનો એ ધારણાને સમર્થન આપે છે કે કેટોન બોડી મેટાબોલિઝમ કાર્બોહાઇડ્રેટથી ભરેલી સ્થિતિઓમાં પણ ફાયદાકારક ભૂમિકા ભજવે છે. � અનુમાન. જ્યારે કેટોન ચયાપચયની ચાલાકી માટે સરળ પોષક અને ફાર્માકોલોજિકલ અભિગમો તેને આકર્ષક રોગનિવારક લક્ષ્ય બનાવે છે, આક્રમક રીતે રજૂ કરવામાં આવે છે પરંતુ સમજદાર પ્રયોગો મૂળભૂત અને અનુવાદ સંશોધન પ્રયોગશાળાઓ બંનેમાં રહે છે. હૃદયની નિષ્ફળતા, સ્થૂળતા, NAFLD/NASH, પ્રકાર 2 ડાયાબિટીસ અને કેન્સરમાં કીટોન ચયાપચયની ભૂમિકાને વ્યાખ્યાયિત કરવાના ક્ષેત્રોમાં અપૂર્ણ જરૂરિયાતો ઉભરી આવી છે. કેટોન બોડીની 'નોન-કેનોનિકલ' સિગ્નલિંગ ભૂમિકાઓનો અવકાશ અને પ્રભાવ, જેમાં પેટીએમના નિયમનનો સમાવેશ થાય છે જે મેટાબોલિક અને સિગ્નલિંગ પાથવેમાં પાછળ અને આગળ વધે છે, માટે ઊંડા સંશોધનની જરૂર છે. છેવટે, એક્સ્ટ્રાહેપેટિક કેટોજેનેસિસ રસપ્રદ પેરાક્રાઇન અને ઓટોક્રાઇન સિગ્નલિંગ મિકેનિઝમ્સ અને નર્વસ સિસ્ટમ અને ટ્યુમરની અંદર સહ-ચયાપચયને પ્રભાવિત કરવાની તકો ખોલી શકે છે અને ઉપચારાત્મક અંત પ્રાપ્ત કરી શકે છે.
સમર્થન
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
ફૂટનોટ્સ
નિષ્કર્ષમાં, જ્યારે માનવ શરીરમાં પૂરતું ગ્લુકોઝ સહેલાઈથી ઉપલબ્ધ ન હોય ત્યારે ઉર્જા સ્ત્રોત તરીકે ઉપયોગમાં લેવા માટે લીવર દ્વારા કીટોન બોડી બનાવવામાં આવે છે. કેટોજેનેસિસ ત્યારે થાય છે જ્યારે લોહીમાં ગ્લુકોઝનું પ્રમાણ ઓછું હોય, ખાસ કરીને અન્ય સેલ્યુલર કાર્બોહાઇડ્રેટ સ્ટોર્સ ખતમ થઈ ગયા પછી. ઉપરના લેખનો હેતુ ઇંધણ ચયાપચય, સિગ્નલિંગ અને થેરાપ્યુટિક્સમાં કેટોન બોડીની બહુ-પરિમાણીય ભૂમિકાઓની ચર્ચા કરવાનો હતો. અમારી માહિતીનો અવકાશ શિરોપ્રેક્ટિક અને કરોડરજ્જુના સ્વાસ્થ્ય સમસ્યાઓ સુધી મર્યાદિત છે. વિષયની ચર્ચા કરવા માટે, કૃપા કરીને ડૉ. જીમેનેઝને પૂછો અથવા અમારો સંપર્ક કરો915-850-0900 .
ડૉ. એલેક્સ જિમેનેઝ દ્વારા ક્યુરેટેડ
આમાંથી સંદર્ભિત:�Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

વધારાના વિષયની ચર્ચા: તીવ્ર પીઠનો દુખાવો
પીઠનો દુખાવોવિકલાંગતાના સૌથી પ્રચલિત કારણોમાંનું એક અને કામના દિવસો ચૂકી જવાના દિવસો છે. પીઠનો દુખાવો એ ડૉક્ટરની ઑફિસની મુલાકાત માટેના બીજા સૌથી સામાન્ય કારણને આભારી છે, જે ફક્ત ઉપલા-શ્વસન માર્ગના ચેપથી વધુ છે. આશરે 80 ટકા વસ્તી તેમના સમગ્ર જીવનમાં ઓછામાં ઓછા એક વખત પીઠનો દુખાવો અનુભવશે. કરોડરજ્જુ એ હાડકાં, સાંધા, અસ્થિબંધન અને સ્નાયુઓ, અન્ય નરમ પેશીઓની વચ્ચે બનેલી જટિલ રચના છે. ઇજાઓ અને/અથવા વિકટ પરિસ્થિતિઓ, જેમ કે�હર્નિયેટ ડિસ્ક, આખરે પીઠના દુખાવાના લક્ષણો તરફ દોરી શકે છે. રમતગમતની ઇજાઓ અથવા ઓટોમોબાઇલ અકસ્માતની ઇજાઓ પીઠના દુખાવા માટેનું સૌથી વારંવારનું કારણ છે, જો કે, કેટલીકવાર સરળ હલનચલન પીડાદાયક પરિણામો લાવી શકે છે. સદનસીબે, વૈકલ્પિક સારવાર વિકલ્પો, જેમ કે ચિરોપ્રેક્ટિક સંભાળ, કરોડરજ્જુના ગોઠવણો અને મેન્યુઅલ મેનિપ્યુલેશન્સના ઉપયોગ દ્વારા પીઠનો દુખાવો ઓછો કરવામાં મદદ કરી શકે છે, આખરે પીડા રાહતમાં સુધારો કરે છે. �

EXTRA EXTRA | મહત્વપૂર્ણ વિષય: ભલામણ કરેલ અલ પાસો, TX શિરોપ્રેક્ટર
***
"ઉપરની માહિતીકેટોન બોડીઝની બહુ-પરિમાણીય ભૂમિકાઓ" લાયકાત ધરાવતા હેલ્થકેર પ્રોફેશનલ અથવા લાઇસન્સ પ્રાપ્ત ચિકિત્સક સાથેના એક-એક-એક સંબંધને બદલવાનો હેતુ નથી અને તે તબીબી સલાહ નથી. અમે તમને તમારા સંશોધન અને લાયક આરોગ્યસંભાળ વ્યાવસાયિક સાથે ભાગીદારીના આધારે આરોગ્યસંભાળના નિર્ણયો લેવા પ્રોત્સાહિત કરીએ છીએ.
અમારી માહિતીનો અવકાશ શિરોપ્રેક્ટિક, મસ્ક્યુલોસ્કેલેટલ, શારીરિક દવાઓ, સુખાકારી, યોગદાન આપતી ઇટીઓલોજિકલ સુધી મર્યાદિત છે વિસેરોસોમેટિક વિક્ષેપ ક્લિનિકલ પ્રસ્તુતિઓની અંદર, સંકળાયેલ સોમેટોવિસેરલ રિફ્લેક્સ ક્લિનિકલ ડાયનેમિક્સ, સબલક્સેશન કોમ્પ્લેક્સ, સંવેદનશીલ સ્વાસ્થ્ય સમસ્યાઓ અને/અથવા કાર્યાત્મક દવા લેખો, વિષયો અને ચર્ચાઓ.
અમે પ્રદાન કરીએ છીએ અને પ્રસ્તુત કરીએ છીએ ક્લિનિકલ સહયોગ વિવિધ શાખાઓના નિષ્ણાતો સાથે. દરેક નિષ્ણાત તેમના વ્યવસાયિક પ્રેક્ટિસના અવકાશ અને તેમના લાઇસન્સના અધિકારક્ષેત્ર દ્વારા સંચાલિત થાય છે. અમે મસ્ક્યુલોસ્કેલેટલ સિસ્ટમની ઇજાઓ અથવા વિકૃતિઓ માટે સારવાર અને સહાયક સંભાળ માટે કાર્યાત્મક આરોગ્ય અને સુખાકારી પ્રોટોકોલનો ઉપયોગ કરીએ છીએ.
અમારા વિડિયો, પોસ્ટ્સ, વિષયો, વિષયો અને આંતરદૃષ્ટિ ક્લિનિકલ બાબતો, મુદ્દાઓ અને વિષયોને આવરી લે છે જે અમારી પ્રેક્ટિસના ક્લિનિકલ અવકાશ સાથે સંબંધિત અને પ્રત્યક્ષ કે પરોક્ષ રીતે સપોર્ટ કરે છે.*
અમારી ઑફિસે સહાયક અવતરણો પ્રદાન કરવાનો વ્યાજબી પ્રયાસ કર્યો છે અને અમારી પોસ્ટ્સને સમર્થન આપતા સંબંધિત સંશોધન અભ્યાસ અથવા અભ્યાસોને ઓળખ્યા છે. વિનંતી પર અમે નિયમનકારી બોર્ડ અને જનતા માટે ઉપલબ્ધ સહાયક સંશોધન અધ્યયનની નકલો પ્રદાન કરીએ છીએ.
અમે સમજીએ છીએ કે અમે એવી બાબતોને આવરી લઈએ છીએ કે જેના માટે કોઈ વિશેષ સમજૂતી યોજના અથવા સારવાર પ્રોટોકોલમાં તે કેવી રીતે સહાય કરી શકે તેના વધારાના સમજૂતીની જરૂર પડે છે; તેથી, ઉપરના વિષયના વિષય પર વધુ ચર્ચા કરવા માટે, કૃપા કરીને પૂછવા માટે મફત લાગે ડૉ. એલેક્સ જિમેનેઝ, ડીસી, અથવા અમને સંપર્ક કરો 915-850-0900.
અમે તમને અને તમારા પરિવારની મદદ માટે અહીં છીએ.
આશીર્વાદ
ડૉ. એલેક્સ જિમેનેઝ ડીસી, એમ.એસ.એ.સી.પી., RN*, સી.સી.એસ.ટી., આઈએફએમસીપી*, CIFM*, એટીએન*
ઇમેઇલ: કોચ
માં ચિરોપ્રેક્ટિક (ડીસી) ના ડૉક્ટર તરીકે લાઇસન્સ ટેક્સાસ & ન્યૂ મેક્સિકો*
ટેક્સાસ ડીસી લાઇસન્સ # TX5807, ન્યુ મેક્સિકો ડીસી લાઇસન્સ # NM-DC2182
રજિસ્ટર્ડ નર્સ (RN*) તરીકે લાઇસન્સ પ્રાપ્ત in ફ્લોરિડા
ફ્લોરિડા લાયસન્સ આરએન લાયસન્સ # RN9617241 (નિયંત્રણ નં. 3558029)
કોમ્પેક્ટ સ્થિતિ: મલ્ટી-સ્ટેટ લાઇસન્સ: માં પ્રેક્ટિસ કરવા માટે અધિકૃત 40 સ્ટેટ્સ*
ડૉ. એલેક્સ જિમેનેઝ ડીસી, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
માય ડિજિટલ બિઝનેસ કાર્ડ